Il solfuro di sodio (solfuro) è un composto chimico con la formula Na2S. È comunemente utilizzato nell’industria della carta e della pasta di legno nonché nel trattamento delle acque per rimuovere i metalli pesanti.
| Nome IUPAC | Solfuro disodico |
| Formula molecolare | Na2S |
| numero CAS | 1313-82-2 |
| Sinonimi | Solfuro di sodio, monosolfuro di sodio, solfuro disodico, solfuro di sodio anidro, solfuro di sodio non idratato, solfuro di sodio |
| InChI | InChI=1S/2Na.S/q2*+1;-2 |
Massa molare del solfuro di sodio
Il solfuro di sodio ha una massa molare di 78,045 g/mol. Ciò significa che una mole di solfuro di sodio contiene 78,045 grammi del composto. La massa molare è una quantità utile per calcolare la quantità di sostanza necessaria per una reazione, nonché per determinare il peso molecolare di un composto.
Punto di ebollizione del solfuro di sodio
Il solfuro di sodio ha un punto di ebollizione relativamente alto >1180°C (2156°F). Ciò significa che è necessaria una quantità significativa di energia per convertire la forma solida del solfuro di sodio nella sua forma gassosa. L’alto punto di ebollizione indica anche che il solfuro di sodio è un composto stabile alle alte temperature.
Punto di fusione del solfuro di sodio
Il solfuro di sodio ha un punto di fusione di 1.180°C (2.156°F). Ciò significa che è necessaria una quantità significativa di energia per convertire la forma solida del solfuro di sodio nella sua forma liquida. L’alto punto di fusione del solfuro di sodio indica anche che è un composto stabile alle alte temperature.
Densità del solfuro di sodio g/ml
La densità del solfuro di sodio varia a seconda della sua forma. La forma anidra del solfuro di sodio ha una densità di 1,856 g/mL, mentre la forma non aidrata ha una densità di 1,58 g/mL. La densità di una sostanza è la massa per unità di volume ed è una quantità utile per determinare la concentrazione di una soluzione.
Peso molecolare del solfuro di sodio
Il peso molecolare del solfuro di sodio è 78,045 g/mol. Ciò significa che una mole di solfuro di sodio contiene 6.022 x 10^23 molecole del composto. Il peso molecolare è una quantità utile per calcolare la quantità di una sostanza necessaria per una reazione, nonché per determinare la massa molare di un composto.
Struttura del solfuro di sodio
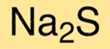
Il solfuro di sodio ha una struttura cristallina nella sua forma anidra. Il composto forma cristalli incolori altamente solubili in acqua. La struttura del composto è composta da cationi sodio (Na+) e anioni solfuro (S2-). Il composto ha un forte legame ionico tra gli ioni sodio e solfuro.
Formula di solfuro di sodio
La formula chimica del solfuro di sodio è Na2S. Ciò significa che ciascuna molecola di solfuro di sodio contiene due cationi di sodio e un anione solfuro. La formula è utile per comprendere la composizione chimica del composto e determinarne le proprietà.
| Aspetto | Solido da giallo a giallo-marrone, deliquescente |
| Peso specifico | 1.856 (anidro), 1.58 (nonidrato) |
| Colore | Da incolore a giallo |
| Odore | Odore di uova marce |
| Massa molare | 78,045 g/mole |
| Densità | 1,856 g/ml (anidro), 1,58 g/ml (nonidrato) |
| Punto di fusione | 1180°C (2156°F) |
| Punto di ebollizione | >1180°C (2156°F) |
| Punto flash | Non applicabile |
| solubilità in acqua | Molto solubile |
| Solubilità | Solubile in etanolo, glicerolo |
| Pressione del vapore | Non applicabile |
| Densità del vapore | Non applicabile |
| pKa | Non applicabile |
| pH | Alcalino, pH ~12 |
Sicurezza e pericoli del solfuro di sodio
Il solfuro di sodio può comportare diversi rischi per la sicurezza. È molto reattivo con l’acqua e può causare gravi irritazioni alla pelle e agli occhi al contatto. L’inalazione del composto può causare irritazione delle vie respiratorie e causare nausea, vomito e diarrea se ingerito. Il composto è inoltre altamente infiammabile e può reagire violentemente con agenti ossidanti. È importante maneggiare il solfuro di sodio con cura e indossare dispositivi di protezione adeguati, come guanti e occhiali protettivi. È inoltre necessario garantire un’adeguata ventilazione durante la manipolazione del composto. In caso di esposizione, è necessario richiedere assistenza medica immediata.
| Simboli di pericolo | Corrosivo, tossico |
| Descrizione della sicurezza | Non respirare la polvere/i fumi/i gas/la nebbia/i vapori/gli aerosol. Indossare guanti/indumenti protettivi/proteggere gli occhi/il viso. IN CASO DI INALAZIONE: trasportare la vittima all’aria aperta e mantenerla a riposo in una posizione che favorisca la respirazione. IN CASO DI CONTATTO CON GLI OCCHI: sciacquare accuratamente con acqua per diversi minuti. Rimuovere le lenti a contatto, se presenti ed è facile da fare. Continua a risciacquare. IN CASO DI CONTATTO CON LA PELLE (o con i capelli): rimuovere immediatamente tutti gli indumenti contaminati. Sciacquare la pelle con acqua/fare una doccia. IN CASO DI INGESTIONE: Sciacquare la bocca. Non provoca il vomito. Chiamare immediatamente un CENTRO ANTIVELENI o un medico. |
| Identificatori AN | ONU1849 |
| Codice SA | 2830.10.00 |
| Classe di pericolo | 8 |
| Gruppo di imballaggio | II |
| Tossicità | Molto tossico; può causare grave irritazione alla pelle e agli occhi, irritazione delle vie respiratorie, nausea, vomito e diarrea in caso di ingestione. Potrebbe essere fatale se ingerito. |
Metodi per la sintesi del solfuro di sodio
Esistono diversi metodi per sintetizzare il solfuro di sodio:
Un metodo comune consiste nel far reagire l’idrossido di sodio (NaOH) con lo zolfo (S) in un forno ad alta temperatura per produrre solfuro di sodio (Na2S) e acqua (H2O).
Un altro metodo prevede la reazione dell’anidride solforosa (SO2) con il solfuro di sodio (Na2S) per formare tiosolfato di sodio (Na2S2O3), quindi la reazione con idrossido di sodio (NaOH) per formare solfuro di sodio (Na2S) e acqua (H2O).
Un terzo metodo prevede la riduzione del solfato di sodio (Na2SO4) con carbonio in presenza di carbone ad alte temperature per produrre solfuro di sodio (Na2S), anidride carbonica (CO2) e monossido di carbonio (CO).
Un altro metodo prevede la reazione del carbonato di sodio (Na2CO3) con lo zolfo (S) in presenza di carbone ad alte temperature per produrre solfuro di sodio (Na2S), anidride carbonica (CO2) e monossido di carbonio. carbonio (CO).
Per sintetizzare il solfuro di sodio, il solfuro di sodio nonaidrato (Na2S.9H2O) può essere fatto reagire con acido solforico (H2SO4) per produrre solfato di sodio (Na2SO4) e anidride solforosa (SO2). Quindi, riscaldare il solfato di sodio con carbone per produrre solfuro di sodio (Na2S) e anidride carbonica (CO2).
Nel complesso, esistono diversi metodi per sintetizzare il solfuro di sodio e la scelta di un metodo particolare dipende da fattori quali la purezza desiderata, la quantità e il rapporto costo-efficacia del prodotto.
Usi del solfuro di sodio
Il solfuro di sodio serve varie industrie con un’ampia gamma di usi.
L’industria della pelle lo utilizza comunemente come agente depilatorio per rimuovere peli e lana da pelli e pellami.
Viene utilizzato come agente solforante per produrre coloranti allo zolfo per i tessili e come agente riducente nella produzione di altri prodotti chimici come l’idrosolfito di sodio.
Nell’industria della pasta di legno e della carta, il solfuro di sodio agisce come agente sbiancante e aiuta a rimuovere la lignina dalla pasta di legno.
Viene anche utilizzato come agente di flottazione nell’estrazione mineraria per separare i minerali di rame, piombo e zinco dalla loro ganga.
Nel settore del trattamento delle acque reflue, il solfuro di sodio viene utilizzato come agente riducente per rimuovere i metalli pesanti dai flussi di effluenti. Inoltre, aiuta come agente declorante a rimuovere il cloro residuo nei processi di trattamento dell’acqua.
L’industria farmaceutica utilizza il solfuro di sodio nella produzione di alcuni farmaci e come agente riducente nelle reazioni di chimica organica.
I laboratori lo utilizzano come reagente nella chimica analitica e come fonte di ioni zolfo nella sintesi chimica.
Nel complesso, il solfuro di sodio è un composto versatile con varie applicazioni in vari settori. Le sue proprietà chimiche uniche lo rendono utile come agente riducente, agente depilatorio, agente flottante e agente declorante, tra gli altri.
Domande:
D: Qual è la carica del catione nel composto ionico solfuro di sodio?
R: Il catione del solfuro di sodio è il sodio (Na+), che ha una carica pari a +1.
D: Qual è la formula del solfuro di sodio?
R: La formula del solfuro di sodio è Na2S, che rappresenta il composto ionico formato dalla combinazione di un catione di sodio (Na+) e un anione solfuro (S2-).
D: Qual è la formula del solfuro di sodio?
R: La formula del solfuro di sodio è Na2S, che rappresenta il composto ionico formato dalla combinazione di un catione di sodio (Na+) e un anione solfuro (S2-).
D: Il solfuro di sodio è solubile?
R: Il solfuro di sodio è solubile in solventi polari come acqua ed etanolo, ma è insolubile in solventi non polari come benzene e cloroformio.
D: Il solfuro di sodio è solubile in acqua?
R: Sì, il solfuro di sodio è altamente solubile in acqua, con una solubilità di circa 50 g/100 ml a temperatura ambiente. Quando il solfuro di sodio viene sciolto in acqua, subisce l’idrolisi per formare idrossido di sodio e gas di idrogeno solforato.
