Il fosfato di sodio bibasico o Na2HPO4 è un composto comunemente usato come agente tampone in laboratorio. Può anche essere trovato in alcuni prodotti alimentari e bevande come additivo alimentare.
| Nome IUPAC | Fosfato disodico idrogeno |
| Formula molecolare | Na2HPO4 |
| numero CAS | 7558-79-4 |
| Sinonimi | Sodio idrogeno fosfato, Sodio fosfato disodico, Sodio fosfato bibasico, Sodio fosfato bibasico anidro, Sodio fosfato bibasico eptaidrato |
| InChI | InChI=1S/2Na.H3O4P/c;;1-5(2,3)4/h;;(H3,1,2,3,4)/q2*+1;/p-2 |
Massa molare di Na2HPO4
La massa molare del fosfato di sodio bibasico è 141,96 g/mol. Questo valore si calcola sommando le masse atomiche di ciascuno degli elementi presenti nel composto, che sono sodio (Na), fosforo (P) e ossigeno (O). La massa molare è un parametro importante utilizzato in vari calcoli, ad esempio per determinare la quantità di una sostanza necessaria per effettuare una reazione o per preparare una soluzione di una certa concentrazione.
Formula di fosfato disodico
La formula chimica del fosfato di sodio bibasico è Na2HPO4. Questa formula rappresenta il rapporto tra ciascuno degli elementi presenti nel composto. La formula è importante per determinare le proprietà chimiche del composto, come la sua reattività e solubilità.
Punto di ebollizione dibasico del fosfato di sodio
Il fosfato di sodio bibasico non ha un punto di ebollizione definito perché si decompone prima di raggiungere il punto di ebollizione. Tuttavia, la temperatura di decomposizione del fosfato di sodio bibasico sarebbe di circa 155°C. A temperature superiori a questo valore, il composto inizia a scomporsi nei suoi ioni costituenti, sodio e fosfato. Questa proprietà lo rende inadatto all’uso in applicazioni che richiedono riscaldamento a temperature elevate.
Punto di fusione del fosfato di sodio bibasico
Il punto di fusione di Na2HPO4 varia a seconda della forma in cui è presente. La forma anidra del composto ha un punto di fusione di 358°C, mentre la forma eptaidrata ha un punto di fusione inferiore di 93°C. Il punto di fusione è un’importante proprietà fisica utilizzata per identificare e caratterizzare le sostanze.
Densità bibasica del fosfato di sodio g/ml
La densità di Na2HPO4 dipende dalla forma in cui è presente. La forma anidra del composto ha una densità di 1,7 g/mL, mentre la forma eptaidrata ha una densità inferiore di 1,68 g/mL. La densità è una proprietà fisica che descrive la quantità di massa contenuta in un determinato volume di una sostanza.
Peso molecolare bibasico del fosfato di sodio
Il peso molecolare di Na2HPO4 è 141,96 g/mol. Questo valore si calcola sommando le masse atomiche di ciascuno degli elementi presenti nel composto. Il peso molecolare è un parametro importante utilizzato in vari calcoli, ad esempio per determinare la quantità di una sostanza necessaria per effettuare una reazione o per preparare una soluzione di una certa concentrazione.
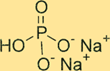
Struttura dibasica del fosfato di sodio
Na2HPO4 ha una struttura cristallina. La forma anidra del composto è una polvere bianca e inodore, mentre la forma eptaidrata è un cristallo incolore e trasparente. Il composto ha una forma tetraedrica attorno all’atomo di fosforo, con ciascun atomo di ossigeno situato agli angoli del tetraedro. Gli ioni sodio si trovano negli spazi interstiziali tra i tetraedri.
| Aspetto | Polvere bianca o cristalli trasparenti |
| Peso specifico | 1,68 – 1,7 g/ml |
| Colore | Da incolore a bianco |
| Odore | Inodore |
| Massa molare | 141,96 g/mole |
| Densità | 1,68 – 1,7 g/ml |
| Punto di fusione | Anidro: 358°C, eptaidrato: 93°C |
| Punto di ebollizione | Si rompe prima dell’ebollizione |
| Punto flash | Non applicabile |
| solubilità in acqua | Molto solubile |
| Solubilità | Solubile in acqua, insolubile in etanolo |
| Pressione del vapore | Non applicabile |
| Densità del vapore | Non applicabile |
| PKa | 2,15 (ione fosfato) |
| PH | 8,0 – 11,0 (soluzione acquosa 0,1 M) |
Sicurezza e pericoli del fosfato di sodio dibasico
Il fosfato di sodio dibasico (Na2HPO4) è generalmente considerato sicuro per l’uso in una varietà di applicazioni, ma può causare irritazione alla pelle e agli occhi. L’inalazione del composto sotto forma di polvere può causare irritazione respiratoria. Na2HPO4 può reagire violentemente con acidi forti e agenti ossidanti e può rilasciare fumi tossici se riscaldato a temperature elevate. Come con tutte le sostanze chimiche, è necessario adottare precauzioni adeguate quando si maneggia questo composto, come indossare indumenti e guanti protettivi e lavorare in un’area ben ventilata. In caso di contatto con la pelle o con gli occhi, sciacquare abbondantemente con acqua e, se necessario, consultare un medico.
| Simboli di pericolo | Nessuno |
| Descrizione della sicurezza | S22 – Non respirare le polveri, S24 – Evitare il contatto con la pelle, S37 – Usare guanti adatti |
| Identificatori AN | UN3077 |
| Codice SA | 28352200 |
| Classe di pericolo | 9 |
| Gruppo di imballaggio | III |
| Tossicità | LD50 (ratto, orale) – 3.400 mg/kg |
Metodi per la sintesi del fosfato di sodio bibasico
Il fosfato di sodio bibasico (Na2HPO4) può essere sintetizzato con diversi metodi, tra cui la reazione dell’acido fosforico con idrossido di sodio, la neutralizzazione dell’acido fosforico con carbonato o bicarbonato di sodio e la reazione del fosfato di sodio monobasico con idrossido di sodio.
- Un metodo comune consiste nel far reagire l’acido fosforico con l’idrossido di sodio in un rapporto 1:2 per produrre Na2HPO4 e acqua. La reazione può essere condotta a temperatura ambiente o sotto blando riscaldamento e il prodotto risultante viene purificato mediante cristallizzazione o evaporazione.
- Un altro metodo consiste nel neutralizzare l’acido fosforico con carbonato o bicarbonato di sodio, seguito dalla precipitazione di Na2HPO4. Il pH della miscela di reazione viene regolato a circa 8-9 utilizzando carbonato o bicarbonato di sodio, e il precipitato risultante viene raccolto e lavato con acqua per rimuovere eventuali impurità.
- Un terzo metodo prevede la reazione del fosfato di sodio monobasico con l’idrossido di sodio in un rapporto 1:1, con conseguente formazione di Na2HPO4 e acqua. Il prodotto risultante viene quindi purificato mediante cristallizzazione o evaporazione.
La scelta del metodo dipende da fattori quali la purezza desiderata, la resa e il rapporto costo-efficacia. La sintesi di Na2HPO4 può essere effettuata con diversi metodi, ognuno dei quali presenta vantaggi e limiti.
Usi del fosfato di sodio bibasico
Il fosfato di sodio dibasico ha molte applicazioni in diversi settori.
- L’industria alimentare lo utilizza come emulsionante, tampone e addensante. Agisce come un sequestrante, aiutando a preservare la qualità e la stabilità del cibo impedendo agli ioni metallici di reagire con altri componenti alimentari. Serve come agente lievitante nel lievito e come regolatore del pH nei latticini.
- L’industria medica lo usa come lassativo per trattare la stitichezza aumentando il contenuto di acqua nel colon. Viene anche utilizzato nella preparazione di medicinali e iniezioni come regolatore del pH e tampone.
- Nel settore agricolo agisce come fertilizzante, fornendo fosforo alle piante.
- Funziona anche come integratore alimentare nei mangimi per animali.
- L’industria del trattamento dell’acqua utilizza Na2HPO4 come inibitore della corrosione e inibitore delle incrostazioni nelle caldaie e nei sistemi di raffreddamento.
- Agisce come detergente, rimuovendo i depositi di calcio e magnesio dalle superfici.
Domande:
D: Il fosfato di sodio bibasico è un conservante?
R: Na2HPO4 generalmente non viene utilizzato come conservante nei prodotti alimentari. Tuttavia, può agire come un sequestrante, che può aiutare a preservare la qualità e la stabilità del cibo impedendo agli ioni metallici di reagire con altri componenti alimentari.
D: Quante moli di fosfato di sodio bibasico (mw 141,98) ci sono in 50 ml di una soluzione al 20% p/v?
R: Per calcolare il numero di moli in una soluzione al 20% p/v di Na2HPO4, dobbiamo prima convertire la percentuale peso/volume in grammi/100 ml. Una soluzione al 20% p/v significa 20 grammi di composto in 100 ml di soluzione. Pertanto, 50 ml di soluzione contengono 10 grammi di Na2HPO4. Per calcolare il numero di moli, dividi la massa per il peso molecolare:
moli = massa/peso molecolare moli = 10 g / 141,98 g/mol moli = 0,070 moli
Pertanto, ci sono 0,070 moli di Na2HPO4 in 50 ml di una soluzione al 20% p/v.
D: Qual è la densità del fosfato di sodio dibasico?
R: La densità di Na2HPO4 dipende dalla forma e dalla concentrazione del composto. La forma anidra ha una densità di circa 2,36 g/cm³, mentre la forma eptaidrata ha una densità di circa 1,62 g/cm³. In soluzione, la densità varierà a seconda della concentrazione.
