Il cloro (Cl2) è un gas giallo-verdastro molto reattivo. Viene utilizzato nel trattamento dell’acqua, come disinfettante e nella produzione di vari prodotti chimici, come PVC e solventi.
| Nome IUPAC | Dicloro |
| Formula molecolare | Cl2 |
| numero CAS | 7782-50-5 |
| Sinonimi | Cloro molecolare, Cloro, Cloro, Cloro, Cloro, Cloreto de cloro |
| InChI | InChI=1S/Cl2/c1-2 |
Cl2 Massa molare
La massa molare di Cl2, o cloro, è la somma delle masse atomiche di due atomi di cloro, ovvero 70,906 g/mol. È importante conoscere la massa molare di Cl2 quando si calcola la quantità di sostanza necessaria per una reazione chimica o quando si converte tra diverse unità di misura.
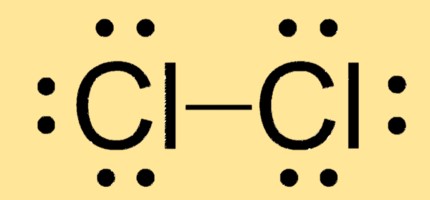
Struttura di Lewis Cl2
Cl2 ha una geometria molecolare lineare con due atomi di cloro legati da un singolo legame covalente. La sua struttura di Lewis è costituita da due atomi di Cl ciascuno con tre coppie solitarie e una coppia di elettroni condivisa tra loro.
Punto di ebollizione Cl2
Il punto di ebollizione di Cl2 è -34,04°C (-29,27°F) a pressione standard. Questo è un punto di ebollizione relativamente basso, che produce Cl2 gassoso a temperatura e pressione ambiente. È importante fare attenzione quando si maneggia Cl2, poiché può facilmente trasformarsi in un liquido o solido a basse temperature e pressioni.
Cl2 Punto di fusione
Il punto di fusione di Cl2 è -101,5°C (-150,7°F) a pressione standard. Questo è un punto di fusione relativamente basso, che produce Cl2 gassoso a temperatura e pressione ambiente. È importante fare attenzione quando si maneggia Cl2, poiché può facilmente trasformarsi in un liquido o solido a basse temperature e pressioni.
Cl2 Densità g/ml
La densità di Cl2 è 0,003214 g/mL a temperatura e pressione standard (STP). Ciò significa che Cl2 è molto meno denso dell’aria e salirà nell’atmosfera. Cl2 può essere immagazzinato in bombole pressurizzate o in serbatoi contenenti gas più pesanti dell’aria come l’azoto.
Peso molecolare del cloro
Il peso molecolare di Cl2 è 70,906 g/mol. Questa è la massa di una mole di Cl2, che contiene il numero di molecole di Avogadro (6,022 x 10^23). Il peso molecolare di Cl2 è importante per i calcoli stechiometrici in chimica.
Struttura del cloro
La struttura di Cl2 è lineare, con due atomi di cloro legati insieme da un legame covalente. La lunghezza del legame tra i due atomi di cloro è 1,99 Ångstrom e l’energia di legame è 242 kJ/mol. La configurazione elettronica di Cl2 è [Ne]3s23p5, con ciascun atomo di cloro che contribuisce con un elettrone alla coppia di legami.
Formula del cloro
La formula per Cl2 è semplicemente due atomi di Cl legati insieme. Questo è rappresentato da Cl-Cl o Cl2. La formula è importante per identificare la composizione di un composto o di una molecola e per i calcoli stechiometrici in chimica.
| Aspetto | Gas giallo verdastro |
| Peso specifico | 1,56 (liquido) |
| Colore | giallo verdastro |
| Odore | Odore pungente e soffocante |
| Massa molare | 70,906 g/mole |
| Densità | 0,003214 g/ml all’STP |
| Punto di fusione | -101,5°C (-150,7°F) |
| Punto di ebollizione | -34,04°C (-29,27°F) |
| Punto flash | Non infiammabile |
| solubilità in acqua | 0,92 g/100 ml a 20°C |
| Solubilità | Solubile in acqua, etanolo, etere, benzene e molti solventi organici |
| Pressione del vapore | 102,44 kPa a 20°C |
| Densità del vapore | 2,49 (aria = 1) |
| pKa | – |
| pH | – |
Cl2 Sicurezza e pericoli
Il cloro è un gas altamente reattivo che può comportare gravi rischi per la sicurezza e la salute se non gestito correttamente. Può causare gravi irritazioni alle vie respiratorie e danni agli occhi, alla pelle e alle mucose. L’inalazione di alte concentrazioni di cloro può causare edema polmonare, che può essere pericoloso per la vita. Il cloro è anche molto corrosivo e può danneggiare metalli, plastica e altri materiali. Per garantire una manipolazione sicura del cloro, è necessario indossare dispositivi di protezione individuale adeguati, come occhiali, guanti e un respiratore. Il cloro deve essere utilizzato solo in aree ben ventilate e tutti i contenitori devono essere adeguatamente etichettati e conservati in un luogo sicuro.
| Simboli di pericolo | Teschio e ossa incrociate |
| Descrizione della sicurezza | Gas altamente tossico e corrosivo; provoca grave irritazione respiratoria e cutanea; può essere fatale se inalato in alte concentrazioni |
| Numeri di identificazione delle Nazioni Unite | UN1017 |
| Codice SA | 2801.1 |
| Classe di pericolo | 2.3 |
| Gruppo di imballaggio | IO |
| Tossicità | Molto tossico; l’inalazione di elevate concentrazioni può causare edema polmonare ed essere fatale |
Metodi di sintesi del cloro
Esistono vari metodi per sintetizzare il cloro gassoso, tra cui l’elettrolisi della salamoia, l’ossidazione dell’HCl e la decomposizione termica dei cloruri metallici.
Il metodo più comune è l’elettrolisi della salamoia, che prevede il passaggio di una corrente elettrica attraverso una soluzione di cloruro di sodio (NaCl) e acqua (H2O). Questo processo genera gas di cloro all’anodo e gas di idrogeno al catodo.
Un altro metodo per produrre cloro è l’ossidazione dell’HCl con un agente ossidante, come KMnO4 o MnO2. Questa reazione produce cloro gassoso e acqua come sottoprodotti.
La decomposizione termica dei cloruri metallici, come MgCl2 o FeCl3, è un altro metodo per generare cloro gassoso. Questo processo prevede il riscaldamento del cloruro di metallo ad alta temperatura, che ne provoca la decomposizione e il rilascio di cloro gassoso.
Nel complesso, il metodo di sintesi utilizzato per il cloro dipende dall’applicazione specifica e dalla purezza desiderata del gas. Indipendentemente dal metodo utilizzato, è importante maneggiare il cloro con cautela a causa della sua natura altamente reattiva e tossica.
Usi del cloro
Il gas di cloro ha una vasta gamma di usi in vari settori. Uno degli usi principali del cloro è la produzione di cloruro di polivinile (PVC), un materiale plastico ampiamente utilizzato. Il cloro viene utilizzato anche nella produzione di altri composti del cloro, come il cloroformio e il tetracloruro di carbonio, che vengono utilizzati come solventi e nella produzione di refrigeranti.
Nell’industria del trattamento dell’acqua, il cloro è comunemente usato come disinfettante per trattare l’acqua potabile e le acque reflue. Il gas di cloro è efficace nell’uccidere batteri e virus e può anche ossidare e rimuovere composti organici e altri contaminanti dall’acqua.
Nell’industria della pasta di legno e della carta, il gas di cloro viene utilizzato come agente sbiancante per sbiancare i prodotti di carta. Viene utilizzato anche nella produzione di tessuti, come nylon e poliestere, nonché nella produzione di coloranti e pigmenti.
Il cloro gassoso trova anche altre applicazioni, in particolare nella produzione di alcuni prodotti farmaceutici e nell’industria metallurgica per la sverniciatura e la pulizia delle superfici metalliche. Tuttavia, a causa della sua natura pericolosa, il cloro deve essere maneggiato con cura e devono essere prese adeguate precauzioni di sicurezza durante lo stoccaggio, il trasporto e l’uso.
Domande:
D: Cl2 è polare o non polare?
R: Cl2 è una molecola non polare.
D: Il cloro è un metallo?
R: No, il cloro non è un metallo. È un alogeno e appartiene al gruppo degli elementi non metallici.
D: Quale metallo tenero si combina con il cloro per produrre il sale da cucina?
R: Il sodio (Na) è il metallo tenero che si combina con il cloro (Cl) per produrre sale da cucina (NaCl).
D: Come clorare l’acqua?
R: La clorazione dell’acqua viene generalmente effettuata aggiungendo una quantità misurata di cloro gassoso, ipoclorito di sodio o ipoclorito di calcio alla fornitura d’acqua. La quantità di cloro aggiunta dipende dalla qualità dell’acqua e dal livello di disinfezione desiderato. Il cloro reagisce con i batteri e altri microrganismi presenti nell’acqua, uccidendoli efficacemente e rendendo l’acqua sicura da bere.
D: Quale dei seguenti viene trattato con cloro per ottenere polvere decolorante?
R: L’ossido di calcio (CaO) viene trattato con cloro (Cl2) per ottenere polvere decolorante (CaOCl2).
