L’etilene, noto anche come etilene, è un gas incolore e infiammabile con un odore dolce. È una parte essenziale dell’industria chimica, utilizzata nella produzione di plastica, solventi e altri prodotti chimici.
| Nome dell’IUPAC | Etene |
| Formula molecolare | C2H4 |
| numero CAS | 74-85-1 |
| Sinonimi | Etilene, etene (in errore), gas oleificante, Elayl, 1,2-diidrogeno etilene |
| InChI | InChI=1S/C2H4/c1-2/h1-2H2 |
Formula dell’etilene
La formula chimica dell’etene è C2H4. Rappresenta il numero e il tipo di atomi presenti in una molecola di etene. La formula viene utilizzata nelle reazioni chimiche e nei calcoli che coinvolgono l’etilene, come determinare la stechiometria di una reazione o la quantità di etilene richiesta per un particolare processo industriale.
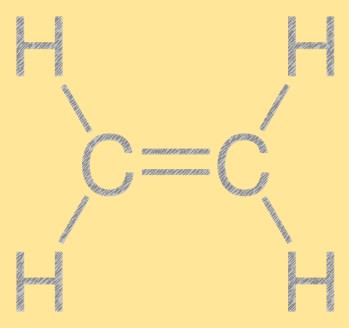
Struttura dell’etilene
L’etilene ha una struttura lineare semplice, con due atomi di carbonio legati da un doppio legame e quattro atomi di idrogeno attaccati a ciascun atomo di carbonio. Il doppio legame carbonio-carbonio è responsabile della reattività dell’etilene, rendendolo un elemento utile nell’industria chimica. La molecola ha una struttura planare, con tutti gli atomi che giacciono sullo stesso piano.
Massa molare dell’etene
La massa molare dell’etene, chiamato anche etilene, è 28,05 g/mol. È una molecola organica semplice composta da due atomi di carbonio e quattro atomi di idrogeno, rappresentata dalla formula chimica C2H4. La massa molare viene calcolata sommando le masse atomiche dei singoli atomi nella molecola.
La massa molare è un parametro importante nelle reazioni chimiche e nei calcoli che coinvolgono l’etilene. Viene utilizzato per determinare la quantità di etilene necessaria in una reazione, nonché la quantità di prodotti che possono essere prodotti.
Punto di ebollizione dell’etilene
Il punto di ebollizione dell’etene è -103,7°C (-154,7°F). L’etilene è un gas a temperatura e pressione ambiente e il suo punto di ebollizione è molto inferiore a quello dell’acqua, il che ne facilita la separazione dalle altre sostanze nei processi industriali.
Il punto di ebollizione dell’etene dipende dalla pressione e dalla purezza del campione. A pressioni più elevate, il punto di ebollizione dell’etene aumenta. Allo stesso modo, le impurità presenti nel campione possono far variare il punto di ebollizione rispetto al valore previsto.
Punto di fusione dell’etene
Il punto di fusione dell’etilene è -169,2°C (-272,6°F). L’etilene è una molecola non polare con una forma lineare, che la rende una molecola relativamente semplice rispetto a molti altri composti organici. Ciò si riflette nel suo basso punto di fusione.
Proprio come il punto di ebollizione, il punto di fusione dell’etilene può variare a seconda della purezza del campione. Le impurità possono abbassare il punto di fusione e rendere difficile ottenere un campione puro per scopi sperimentali.
Densità dell’etilene g/ml
La densità dell’etilene è 0,958 g/mL in condizioni di temperatura e pressione standard (STP), definite come 0°C (32°F) e 1 atm di pressione. L’etilene è meno denso dell’aria, il che significa che può salire e disperdersi nell’atmosfera.
La densità è un’importante proprietà fisica dell’etilene perché viene utilizzata nei processi industriali per determinare la quantità di etilene necessaria per un dato volume di spazio. Viene anche utilizzato per calcolare la massa di etilene in un campione.
Peso molecolare dell’etilene
Il peso molecolare dell’etilene è 28,05 g/mol. È la somma dei pesi atomici degli atomi che costituiscono la molecola. Il peso molecolare è un parametro importante in molti calcoli chimici, in particolare nel determinare la stechiometria di una reazione e la quantità di reagenti e prodotti richiesti o prodotti.
| Aspetto | Gas incolore |
| Densità specifica | 0,968 g/ml a 20°C (68°F) |
| Colore | Incolore |
| Odore | Dolce, piccante |
| Massa molare | 28,05 g/mole |
| Densità | 0,958 g/ml a 0°C e 1 atm |
| Punto di fusione | -169,2°C (-272,6°F) |
| Punto di ebollizione | -103,7°C (-154,7°F) alla pressione di 1 atm |
| Punto flash | -136°C (-213°F) |
| solubilità in acqua | 3,5 g/l a 25°C (77°F) |
| Solubilità | Insolubile in acqua, solubile in solventi organici |
| Pressione del vapore | 114,6 kPa a 20°C (68°F) |
| Densità del vapore | 0,97 (aria = 1) |
| pKa | 44 |
| pH | Non applicabile poiché l’etilene non è una soluzione acquosa |
Sicurezza e pericoli dell’etilene
L’etilene è un gas altamente infiammabile che può formare miscele esplosive con l’aria. Può accendersi spontaneamente nell’aria se la concentrazione è sufficientemente elevata. L’etilene è anche un asfissiante e può sostituire l’ossigeno in spazi ristretti, costituendo un pericolo scioccante.
Il contatto con etilene liquido o l’esposizione ad alte concentrazioni di gas può causare congelamento o ustioni. L’etilene non è tossico, ma i suoi prodotti di combustione, tra cui il monossido di carbonio e l’anidride carbonica, possono essere pericolosi per la salute umana.
La manipolazione dell’etilene richiede misure di sicurezza adeguate, tra cui un’adeguata ventilazione, dispositivi di protezione individuale e precauzioni di sicurezza antincendio. L’etilene deve essere immagazzinato e trasportato in aree ben ventilate, lontano da fonti di ignizione.
| Simboli di pericolo | Gas infiammabile (GHS02), asfissiante semplice (GHS09) |
| Descrizione della sicurezza | Tenere lontano da fiamme e scintille – Non fumare. Utilizzare solo strumenti antiscintilla. Non respirare il gas. Utilizzare solo all’aperto o in un’area ben ventilata. Indossare guanti/indumenti protettivi/proteggere gli occhi/il viso. |
| Numeri di identificazione delle Nazioni Unite | ONU 1962 (gas compresso) |
| Codice SA | 2901.21.00 |
| Classe di pericolo | 2.1 (gas infiammabile) |
| Gruppo di imballaggio | N / A |
| Tossicità | Non tossico |
Metodi di sintesi dell’etilene
Vari metodi possono essere utilizzati per sintetizzare l’etilene, compreso il cracking termico degli idrocarburi e la disidratazione degli alcoli.
Nel cracking termico, il processo prevede il riscaldamento di idrocarburi come metano, propano e nafta ad alte temperature (da 500 a 900 °C) in presenza di un catalizzatore per scomporre le molecole a catena lunga in molecole più piccole, producendo così etilene. prodotti.
Un altro metodo comune è la disidratazione dell’alcol, che prevede l’utilizzo di un catalizzatore come allumina o silice ad alte temperature (250-350°C) per disidratare l’etanolo o altri alcoli e formare etilene e acqua.
Lo steam cracking è un altro processo utilizzato per produrre etilene, in cui il vapore viene aggiunto agli idrocarburi ad alte temperature (700-900°C) per generare una miscela di etilene e altri prodotti.
Anche la decomposizione termica di materiali organici come legno, carta e plastica può generare etilene.
Altri metodi per sintetizzare l’etilene includono la deidrogenazione ossidativa dell’etano e il processo di conversione del metanolo in olefine.
Usi dell’etilene
L’etilene è un importante prodotto chimico industriale con una vasta gamma di usi.
- L’etilene svolge un ruolo cruciale nella produzione del polietilene, una delle plastiche più utilizzate al mondo. Le persone utilizzano il polietilene in varie applicazioni come imballaggi, tubi e materiali da costruzione.
- I produttori utilizzano l’etilene come ingrediente chiave nella produzione di altri polimeri, come il cloruro di polivinile (PVC). Il PVC è utile nei materiali da costruzione, nei dispositivi medici e nei cavi elettrici.
- L’etilene è fondamentale anche nella produzione dell’ossido di etilene, una materia prima essenziale nella produzione di detergenti, solventi e plastica.
- I produttori utilizzano l’etilene per produrre glicole etilenico, un liquido refrigerante e antigelo per i motori. È anche una materia prima nella produzione di fibre, pellicole e resine di poliestere.
- L’etilene è utilizzato come combustibile per la saldatura e il taglio dei metalli. Agisce anche come agente di maturazione per frutta e verdura.
- L’etilene è utile nella sintesi di vari composti organici, tra cui etanolo e acetaldeide.
Nel complesso, la versatilità dell’etilene lo rende un componente essenziale in un’ampia gamma di processi industriali, contribuendo a molti aspetti della vita moderna.
Domande:
Quali dieni reagiscono con l’etilene in una reazione di Diels-Alder?
Qualsiasi diene contenente due doppi legami coniugati può subire una reazione di Diels-Alder con l’etene. Esempi di tali dieni includono 1,3-butadiene e isoprene.
Come sono disposti gli atomi di idrogeno nell’etene?
Nell’etene i due atomi di carbonio sono legati tra loro da un doppio legame. Ogni atomo di carbonio è anche legato a due atomi di idrogeno, con le restanti valenze occupate da due coppie di elettroni non condivisi su ciascun atomo di carbonio. La disposizione degli atomi attorno a ciascun carbonio è trigonale.
Quanti legami pi si formano quando avviene l’ibridazione sp2 nell’etene, C2H4?
Quando si verifica l’ibridazione sp2 nell’etene, si forma un legame pi tra i due atomi di carbonio. Gli orbitali ibridi sp2 partecipano alla formazione di legami sigma tra atomi di carbonio e atomi di idrogeno, mentre gli orbitali p di ciascun atomo di carbonio si sovrappongono per formare il legame pi. L’etilene è classificato come idrocarburo insaturo perché ha un doppio legame tra i suoi due atomi di carbonio. Questo doppio legame è costituito da un legame sigma e un legame pi greco, il che significa che l’etene ha meno atomi di idrogeno rispetto a un idrocarburo saturo comparabile con lo stesso numero di atomi di carbonio.
