Il nitrobenzene o C6H5NO2 è un composto organico con un colore giallo pallido e un odore distinto. Viene utilizzato come precursore per la produzione di anilina e altri prodotti chimici. È anche una sostanza tossica.
| Nome IUPAC | Nitrobenzene |
| Formula molecolare | C6H5NO2 |
| numero CAS | 98-95-3 |
| Sinonimi | Nitrobenzol, Nitrobenzeen, Essenza di Mirbane, NB |
| InChI | InChI=1S/C6H5NO2/c8-7(9)6-4-2-1-3-5-6/h1-5H |
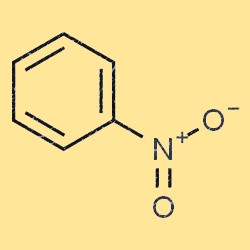
Struttura del nitrobenzene
Il nitrobenzene ha una struttura molecolare piatta e planare. È costituito da un anello benzenico (C6H5) con un gruppo nitro (-NO2) attaccato a uno degli atomi di carbonio. Il gruppo nitro è un gruppo che attrae elettroni, il che significa che riduce la densità elettronica dell’anello benzenico. Questa proprietà rende il nitrobenzene meno reattivo del benzene in molte reazioni chimiche.
Formula del nitrobenzene
La formula chimica del nitrobenzene è C6H5NO2. Questa formula rappresenta il numero e il tipo di atomi che compongono la molecola. L’anello benzenico costituisce la struttura portante della molecola, mentre il gruppo nitro costituisce un gruppo funzionale polare che influenza le proprietà del composto. La formula del nitrobenzene è importante per comprenderne le proprietà chimiche e fisiche e la sua reattività con altre sostanze.
Massa molare del nitrobenzene
La massa molare del nitrobenzene, chiamato anche C6H5NO2, è 123,11 g/mol. Questo si calcola sommando le masse atomiche di tutti gli atomi presenti nel composto. Il nitrobenzene ha una massa molare relativamente elevata, a causa della presenza di sei atomi di carbonio e un atomo di azoto nella sua struttura chimica.
Punto di ebollizione del nitrobenzene
Il nitrobenzene ha un punto di ebollizione di 210,9°C. Questo è relativamente elevato rispetto ad altri composti organici con pesi molecolari simili. L’alto punto di ebollizione è dovuto alla presenza di forti forze attrattive intermolecolari tra le molecole di nitrobenzene, come i legami idrogeno e le interazioni dipolo-dipolo.
Punto di fusione del nitrobenzene
Il punto di fusione del nitrobenzene è 5,85°C. Questo è relativamente basso rispetto al suo punto di ebollizione, il che può essere spiegato dal fatto che le forze di attrazione intermolecolari allo stato solido sono più deboli che allo stato liquido. Inoltre, il nitrobenzene può mostrare polimorfismo, il che significa che può esistere in più strutture cristalline con diversi punti di fusione.
Densità del nitrobenzene g/ml
La densità del nitrobenzene è 1,20 g/mL a temperatura ambiente (25°C). Ciò significa che il nitrobenzene è più denso dell’acqua, che alla stessa temperatura ha una densità di 1 g/ml. La densità del nitrobenzene è influenzata dal suo peso molecolare e dalla dimensione e dalla forma delle sue molecole.
Peso molecolare del nitrobenzene
Il peso molecolare del nitrobenzene è 123,11 g/mol. Questo si calcola sommando le masse atomiche di tutti gli atomi presenti nel composto. Il peso molecolare del nitrobenzene è importante per determinarne le proprietà fisiche e chimiche, come il punto di ebollizione, il punto di fusione e la solubilità.
| Aspetto | Liquido giallo pallido |
| Peso specifico | 1,20 g/cm3 |
| Colore | Giallo pallido |
| Odore | Caratteristica |
| Massa molare | 123,11 g/mole |
| Densità | 1,20 g/ml a 25°C |
| Punto di fusione | 5,85°C |
| Punto di ebollizione | 210,9°C |
| Punto flash | 77°C |
| solubilità in acqua | 7,9 g/l a 25°C |
| Solubilità | Solubile in solventi organici |
| Pressione del vapore | 0,68 mmHg a 25°C |
| Densità del vapore | 4.35 (aria=1) |
| pKa | -1.15 |
| pH | 7 (neutro) |
Sicurezza e pericoli del nitrobenzene
Il nitrobenzene è una sostanza altamente tossica che comporta numerosi rischi per la sicurezza e la salute. Può causare irritazione alla pelle, agli occhi e alle vie respiratorie per contatto o inalazione. L’esposizione prolungata al nitrobenzene può causare danni al fegato e ai reni, anemia e metaemoglobinemia. Il nitrobenzene è anche molto infiammabile e può accendersi a temperature relativamente basse. Inoltre, può rilasciare fumi tossici se riscaldato, bruciato o decomposto. È quindi fondamentale maneggiare il nitrobenzene con cura, indossare adeguati dispositivi di protezione e conservarlo in un luogo fresco e asciutto, lontano da fonti di ignizione e sostanze incompatibili.
| Simboli di pericolo | T, N |
| Descrizione della sicurezza | Molto tossico, nocivo se ingerito, inalato o assorbito attraverso la pelle, provoca gravi ustioni cutanee e gravi lesioni oculari. |
| Identificatori AN | UN1662 |
| Codice SA | 2904.90.90 |
| Classe di pericolo | 6.1 |
| Gruppo di imballaggio | II |
| Tossicità | Molto tossico |
Metodi di sintesi del nitrobenzene
Il nitrobenzene può essere sintetizzato con diversi metodi, tra cui la nitrazione del benzene, la riduzione del nitrobenzene e l’idrogenazione del nitrobenzene. Il metodo più comunemente utilizzato è la nitrazione del benzene, che prevede la reazione del benzene con una miscela di acido nitrico e acido solforico ad una temperatura di circa 50°C. La reazione di nitrazione produce una miscela di nitrobenzene e altri nitro derivati del benzene.
Un altro metodo per sintetizzare il nitrobenzene è la riduzione del nitrobenzene, che prevede l’uso di agenti riducenti come ferro o zinco e acido cloridrico. La reazione di riduzione converte il gruppo nitro (-NO2) del nitrobenzene in un gruppo amminico (-NH2), producendo anilina come sottoprodotto.
L’idrogenazione del nitrobenzene è un altro metodo di sintesi dell’anilina. Questo metodo prevede l’uso di un catalizzatore, come nichel o palladio, e idrogeno gassoso, che reagisce con il nitrobenzene per produrre anilina.
Usi del nitrobenzene
Il nitrobenzene è una sostanza chimica versatile utilizzata in un’ampia gamma di applicazioni.
- L’industria chimica utilizza il nitrobenzene come precursore dell’anilina, un ingrediente importante nella produzione di coloranti, gomma e prodotti farmaceutici. Il nitrobenzene è una preziosa materia prima per la produzione di altri prodotti chimici come il fenolo, utilizzato nella produzione di plastica, resine e adesivi.
- I composti organici come oli, grassi e cere possono essere sciolti utilizzando il nitrobenzene, rendendolo un utile solvente. Nell’industria alimentare, il nitrobenzene viene utilizzato come agente aromatizzante, principalmente nella produzione di gomme da masticare.
- C6H5NO2 è un componente essenziale nella produzione di esplosivi come il TNT (trinitrotoluene). Come additivo per carburante, il nitrobenzene aiuta ad aumentare il numero di ottani della benzina.
- C6H5NO2 viene utilizzato anche nella produzione di vari pesticidi ed erbicidi, inclusi insetticidi e fungicidi.
- Anche la produzione di fibre sintetiche come il nylon si basa sul nitrobenzene come componente essenziale.
Nel complesso, la natura versatile del nitrobenzene lo rende una sostanza chimica essenziale in molti settori, tra cui quello chimico, alimentare e tessile. Tuttavia, quando si utilizza il nitrobenzene sono necessarie una corretta manipolazione e precauzioni di sicurezza a causa della sua tossicità e infiammabilità.
Domande:
Reazione del nitrobenzene con anilina
La conversione del nitrobenzene in anilina è una reazione in due fasi che prevede la riduzione del gruppo nitro (-NO2) ad un gruppo amminico (-NH2) e la successiva idrolisi del prodotto intermedio.
La riduzione di C6H5NO2 viene solitamente ottenuta utilizzando un agente riducente, come ferro o zinco, e una soluzione acida, come l’acido cloridrico. La reazione produce un prodotto intermedio, il nitrosobenzene, che viene poi ridotto ad anilina in presenza di un catalizzatore acido o basico.
L’idrolisi dell’intermedio nitrosobenzene in anilina viene ottenuta trattando l’intermedio con una soluzione acida, come acido cloridrico diluito. La reazione produce anilina, acqua e ossido di azoto (NO).
La reazione complessiva può essere rappresentata come segue: Nitrobenzene + 3 H2 → Anilina + 2 H2O + N2
