Il butanale o butirraldeide è un composto organico con la formula C4H8O. È un liquido incolore con un odore pungente ed è comunemente usato come materia prima per la sintesi di altri prodotti chimici.
| Nome IUPAC | Butanale |
| Formula molecolare | C4H8O |
| numero CAS | 123-72-8 |
| Sinonimi | Butirraldeide, aldeide butirrica, butanaldeide, butirrale, N-butanale, butaldeide, butirril idruro, 1-butanale, 1-butirraldeide |
| InChI | InChI=1S/C4H8O/c1-2-3-4-5/h4H,2-3H2,1H3 |
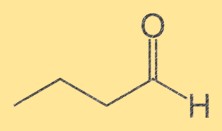
Struttura butanale
La struttura del Butanal è costituita da una catena di quattro atomi di carbonio con attaccato un gruppo aldeidico terminale (-CHO). Gli atomi di carbonio sono numerati in sequenza, con il gruppo aldeidico attaccato al primo carbonio. La struttura del Butanal è importante perché ne determina le proprietà chimiche e fisiche.
Spettro IR butanale
Lo spettro infrarosso (IR) del Butanal viene utilizzato per identificare i gruppi funzionali presenti nella molecola. Lo spettro IR del Butanal mostra picchi caratteristici per il gruppo carbonilico (-C=O) a circa 1730 cm-1, e per le vibrazioni di stretching del CH a circa 2800-3000 cm-1. Lo spettro IR è un potente strumento in chimica organica per identificare e caratterizzare i composti.
Massa molare del butanale
Il butanale ha una massa molare di 72,11 g/mol. La massa molare di un composto è la somma delle masse atomiche di tutti gli atomi presenti in una molecola di quel composto. Nel caso del Butanal, la massa molare viene calcolata sommando le masse atomiche di quattro atomi di carbonio, otto atomi di idrogeno e un atomo di ossigeno.
Punto di ebollizione del butanale
Il punto di ebollizione del Butanal è 75°C o 167°F. Questa è la temperatura alla quale la pressione del vapore del liquido è uguale alla pressione atmosferica e il liquido inizia a bollire. Il butanal ha un punto di ebollizione relativamente basso, che lo rende volatile ed evapora facilmente a temperatura ambiente.
Punto di fusione del butanale
Il punto di fusione del Butanal è -97°C o -143°F. Questa è la temperatura alla quale una sostanza solida passa allo stato liquido. Il butanal ha un punto di fusione molto basso, il che significa che di solito è allo stato liquido a temperatura ambiente.
Densità della butirraldeide g/ml
La densità della butirraldeide è 0,81 g/mL. La densità è la quantità di massa per unità di volume ed è solitamente espressa in grammi per millilitro per i liquidi. La butirraldeide ha una densità inferiore a quella dell’acqua, il che significa che galleggia sulla superficie dell’acqua.
Peso molecolare della butirraldeide
Il peso molecolare della butirraldeide è 72,11 g/mol. È uguale alla massa molare e rappresenta la massa di una molecola di butirraldeide. Il peso molecolare è un parametro importante utilizzato nei calcoli e nelle analisi chimiche.
Formula di butirraldeide
La formula chimica della butirraldeide è C4H8O. Questa formula indica il numero di atomi di ciascun elemento in una molecola di butirraldeide. Ci sono quattro atomi di carbonio, otto atomi di idrogeno e un atomo di ossigeno nella butirraldeide.
| Aspetto | Liquido incolore |
| Peso specifico | 0,81 g/ml |
| Colore | Incolore |
| Odore | Piccante, pungente |
| Massa molare | 72,11 g/mole |
| Densità | 0,81 g/ml |
| Punto di fusione | -97°C (-143°F) |
| Punto di ebollizione | 75°C (167°F) |
| Punto flash | -6,7°C (20°F) |
| solubilità in acqua | Miscibile |
| Solubilità | Solubile in etanolo, etere, acetone |
| Pressione del vapore | 44 mmHg a 20°C |
| Densità del vapore | 2,5 (aria=1) |
| pKa | 16.92 |
| pH | 4.5-6.5 |
Sicurezza e pericoli del butanal
La butirraldeide è un liquido infiammabile e può presentare pericolo di incendio se esposto a calore o fiamme. Può anche causare irritazione agli occhi e alla pelle al contatto e l’inalazione di vapori può causare irritazione delle vie respiratorie. Pertanto, è importante maneggiare la butirraldeide con cautela, indossando adeguati dispositivi di protezione individuale, come guanti e occhiali protettivi. Dovrebbe essere conservato in un luogo fresco, asciutto e ben ventilato, lontano da fonti di calore e ignizione. Se esposto o ingerito, consultare immediatamente un medico. È anche importante seguire adeguate procedure di smaltimento dei rifiuti per la butirraldeide per prevenire la contaminazione dell’ambiente.
| Simboli di pericolo | Fiamma, Corrosivo, Irritante |
| Descrizione della sicurezza | Tenere lontano da fonti di calore/scintille/fiamme libere/superfici calde. Indossare guanti protettivi/proteggere gli occhi/il viso. IN CASO DI CONTATTO CON LA PELLE (o con i capelli): rimuovere immediatamente tutti gli indumenti contaminati. Sciacquare la pelle con acqua/fare una doccia. In caso di incendio: utilizzare polvere chimica secca per estinguere. |
| Numeri di identificazione delle Nazioni Unite | UN1125 |
| Codice SA | 2912.19.00 |
| Classe di pericolo | 3 |
| Gruppo di imballaggio | II |
| Tossicità | Il butanal è dannoso se ingerito, inalato o assorbito attraverso la pelle. Può causare irritazione agli occhi e alla pelle e un’esposizione prolungata può causare danni al fegato e ai reni. È stato anche dimostrato che è mutageno e cancerogeno negli studi sugli animali. La corretta manipolazione e smaltimento sono importanti per prevenire l’esposizione e la contaminazione. |
Metodi di sintesi del butanale
La butirraldeide può essere sintetizzata con vari metodi, tra cui l’ossidazione degli alcoli primari, l’ozonolisi degli alcheni e l’idroformilazione degli alcheni.
Un metodo comune per sintetizzare la butirraldeide è l’ossidazione degli alcoli primari utilizzando un agente ossidante come il permanganato di potassio o l’acido cromico. L’alcol primario viene prima convertito nell’aldeide corrispondente utilizzando un agente riducente blando come il clorocromato di piridinio e quindi ossidato in butirraldeide. Un altro metodo prevede l’ozonolisi degli alcheni per produrre aldeidi, che possono poi essere ridotte a butirraldeide utilizzando un agente riducente come il boroidruro di sodio.
L’idroformilazione degli alcheni è anche un metodo comunemente usato per sintetizzare la butirraldeide. Ciò comporta una reazione dell’alchene con monossido di carbonio e idrogeno gassoso in presenza di un catalizzatore come il cobalto carbonile o il complesso di rodio. L’aldeide risultante può quindi essere ridotta a butirraldeide utilizzando un agente riducente come idruro di litio alluminio.
Altri metodi per sintetizzare la butirraldeide includono la reazione dei reagenti di Grignard con formaldeide e la reazione dei chetoni con acido formico e idrogeno gassoso in presenza di un catalizzatore.
Nel complesso, la scelta del metodo di sintesi dipende da fattori quali la disponibilità delle materie prime, la resa e la purezza desiderate e la fattibilità delle condizioni di reazione.
Usi del butanale
Il butanal ha vari usi industriali e commerciali grazie alla sua reattività e al suo odore distinto.
Uno degli usi principali del butanal è come materia prima per la produzione di altri prodotti chimici, come il butil acrilato e l’n-butanolo. Queste sostanze chimiche vengono utilizzate nella produzione di rivestimenti, adesivi e materie plastiche.
Il butanal viene utilizzato anche come agente aromatizzante nell’industria alimentare, fornendo un aroma fruttato, simile alla mela, a vari prodotti come prodotti da forno, caramelle e bevande. Viene anche utilizzato come fragranza nei profumi e nei saponi.
Inoltre, il Butanal viene utilizzato come solvente nella sintesi organica e come reagente nelle reazioni di chimica organica. Può essere utilizzato per convertire le aldeidi in alcoli secondari e per produrre esteri reagendo con acidi carbossilici.
Il butanal è stato utilizzato anche in studi di ricerca come strumento per comprendere i meccanismi di attivazione dei recettori olfattivi nel cervello, a causa del suo forte odore.
Tuttavia, è importante notare che Butanal può comportare rischi per la sicurezza se non maneggiato correttamente e che è necessario adottare precauzioni adeguate durante l’utilizzo e la conservazione. Nel complesso, la versatilità e le proprietà uniche del Butanal lo rendono un prodotto chimico importante in vari settori e aree di ricerca.
Domande:
Qual è l’entalpia standard di formazione della butirraldeide liquida, ch3ch2ch2cho(l)?
L’entalpia standard di formazione (∆H°f) della butirraldeide liquida (CH3CH2CH2CHO(l)) a 25°C è -146,6 kJ/mol.
Ciò significa che la variazione di entalpia associata alla formazione di 1 mole di butirraldeide liquida dai suoi elementi costituenti nei loro stati standard (in questo caso carbonio, idrogeno e ossigeno nelle loro forme elementari) è -146,6 kJ/mol a 25°C . e 1 atm di pressione.
Il segno negativo indica che la reazione è esotermica, ovvero che cede calore. Questo valore è utile per calcolare la variazione di entalpia delle reazioni che coinvolgono la butirraldeide come reagente o prodotto.
