Lo zincato di sodio è un composto chimico con la formula Na2Zn(OH)4. È una polvere solida bianca utilizzata come precursore nella sintesi di nanoparticelle di ossido di zinco e come reagente in chimica organica.
| Nome IUPAC | Zincato di sodio |
| Formula molecolare | Na2Zn(OH)4 |
| numero CAS | 12179-14-5 |
| Sinonimi | Idrossido di sodio e zinco, zinco di sodio, tetraidrossizincato disodico, zinco, tetraidrossido |
| InChI | InChI=1S/2Na.O2Zn/c;;1-3-5-6-4-2/q2*+1;-2; |
Formula di zinco di sodio
La formula chimica dello zincato di sodio è Na2Zn(OH)4, che indica che contiene due ioni sodio (Na+) e uno ione ossido di zinco (ZnO2-). La formula viene utilizzata per rappresentare la composizione del composto e può essere utilizzata per calcolare la massa molare, il peso molecolare e altre proprietà del composto. La formula può essere utilizzata anche per scrivere equazioni chimiche e prevedere i prodotti delle reazioni che coinvolgono lo zincato di sodio.
Massa molare del sodio zincato:
La massa molare dello zincato di sodio si calcola sommando le masse atomiche di tutti gli elementi presenti in una mole del composto. Per lo zinco di sodio (Na2Zn(OH)4), la massa molare è di circa 179,42 g/mol. Questo valore può essere utile per determinare la quantità di zinco di sodio necessaria per preparare una quantità specifica di soluzione o per determinare la massa del composto in un dato campione.
Punto di ebollizione dello zincato di sodio:
Na2Zn(OH)4 è un composto solido e non ha punto di ebollizione. Tuttavia, si decompone ad alte temperature e i gas risultanti possono avere punti di ebollizione a seconda della loro composizione. Pertanto, il punto di ebollizione di Na2Zn(OH)4 non è una proprietà rilevante.
Densità di Zincato di Sodio g/ml:
La densità di Na2Zn(OH)4 è di circa 2,7 g/cm³. Questo valore può essere utile per determinare la massa di un volume specifico di Na2Zn(OH)4 o per determinare il volume di una massa specifica di zincato di sodio. La densità dipende dalla temperatura e dalla pressione e può variare a seconda delle condizioni specifiche dell’esperimento.
Peso molecolare dello zincato di sodio:
Il peso molecolare di Na2Zn(OH)4 viene calcolato sommando i pesi atomici di tutti gli atomi della molecola. Lo zincato di sodio ha un peso molecolare di circa 179,42 g/mol. Il peso molecolare è una proprietà importante perché viene utilizzato nei calcoli relativi alla quantità di zincato di sodio richiesta in una reazione o formulazione.
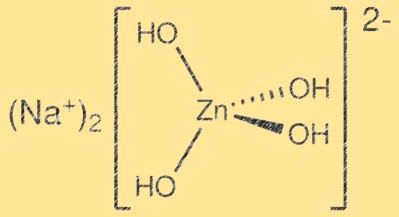
Struttura dello zincato di sodio:
Na2Zn(OH)4 ha una struttura cristallina complessa con strati di tetraedri ZnO4 e ottaedri Na2O6. I tetraedri ZnO4 condividono gli angoli per formare un reticolo tridimensionale, mentre gli ottaedri Na2O6 occupano gli spazi interstiziali. La struttura risultante è stratificata e può essere descritta come un derivato della struttura della wurtzite. Gli strati sono tenuti insieme dalle forze di Van der Waals e la struttura cristallina risultante è relativamente debole.
| Aspetto | Polvere solida bianca |
| Peso specifico | 2,7 g/cm³ |
| Colore | Bianco |
| Odore | Inodore |
| Massa molare | 179,42 g/mole |
| Densità | 2,7 g/cm³ |
| Punto di fusione | N / A |
| Punto di ebollizione | N / A |
| Punto flash | N / A |
| solubilità in acqua | Solubile |
| Solubilità | Solubile in acqua, insolubile nei solventi organici |
| Pressione del vapore | N / A |
| Densità del vapore | N / A |
| pKa | N / A |
| pH | Alcalino (pH > 7) |
Si noti che alcune proprietà, come il punto di infiammabilità e la pressione del vapore, non sono rilevanti per lo zincato di sodio perché è un composto solido.
Sicurezza e pericoli dello zincato di sodio
Na2Zn(OH)4 presenta alcuni rischi per la sicurezza e i pericoli che devono essere considerati quando si maneggia il composto. È importante indossare dispositivi di protezione individuale adeguati, come guanti e occhiali di sicurezza, quando si maneggia Na2Zn(OH)4. Il composto può causare irritazione alla pelle e agli occhi e l’ingestione può provocare disturbi gastrointestinali. Na2Zn(OH)4 può anche rappresentare un pericolo di incendio e deve essere conservato in un luogo fresco e asciutto, lontano da fonti di calore e fonti di ignizione. Una corretta manipolazione e conservazione di Na2Zn(OH)4 può aiutare a ridurre al minimo i rischi associati al composto.
| Simboli di pericolo | Nessuno |
| Descrizione della sicurezza | S22: Non respirare le polveri. S24/25: Evitare il contatto con la pelle e gli occhi. S37/39: Usare guanti adatti e proteggersi gli occhi/la faccia. |
| Numeri di identificazione delle Nazioni Unite | Non applicabile |
| Codice SA | 2834.29 |
| Classe di pericolo | Non classificato come pericoloso |
| Gruppo di imballaggio | Non applicabile |
| Tossicità | L’esatta tossicità dello zincato di sodio non è ben caratterizzata, ma può causare irritazione alla pelle e agli occhi e può essere dannoso se ingerito. È importante maneggiare il composto con cura e indossare adeguati dispositivi di protezione individuale. |
Metodi per la sintesi dello zincato di sodio
Esistono diversi metodi che è possibile utilizzare per sintetizzare Na2Zn(OH)4, ma il metodo più comune prevede la miscelazione di ossido di zinco e idrossido di sodio in una soluzione acquosa. Per prima cosa devi mescolare l’ossido di zinco con l’idrossido di sodio in una soluzione acquosa. Quindi scaldare e mescolare la miscela fino a formare una soluzione limpida. Una volta raffreddata la soluzione, dalla soluzione precipiterà Na2Zn(OH)4, che dovrà essere lavata con acqua ed essiccata per ottenere il prodotto finale.
Un altro modo per sintetizzare Na2Zn(OH)4 è aggiungere zinco a una soluzione di idrossido di sodio e riscaldare la miscela fino a formare una soluzione limpida. Una volta raffreddata la soluzione, dalla soluzione precipiterà Na2Zn(OH)4, che dovrà essere lavata con acqua ed essiccata per ottenere il prodotto finale.
È fondamentale eseguire la sintesi di Na2Zn(OH)4 in un’area ben ventilata e indossare adeguati dispositivi di protezione individuale. È necessario prestare attenzione anche quando si maneggia l’idrossido di sodio, poiché può essere corrosivo e causare irritazione alla pelle e agli occhi.
Usi dello zincato di sodio
Vari settori utilizzano Na2Zn(OH)4 per molteplici scopi. Una delle sue principali applicazioni è come precursore per la sintesi dell’ossido di zinco, che i produttori utilizzano nella produzione di gomma, ceramica e altri prodotti. Na2Zn(OH)4 agisce come stabilizzante nella produzione di fibre sintetiche e plastica.
Nel settore agricolo, gli agricoltori utilizzano Na2Zn(OH)4 come fertilizzante per fornire alle piante nutrienti essenziali come lo zinco. Può anche proteggere le colture dalle malattie fungine, fungendo da fungicida.
I produttori di pigmenti, come il giallo di zinco, utilizzano nella loro produzione Na2Zn(OH)4, comunemente utilizzato nelle vernici e nei rivestimenti. Inoltre, le industrie utilizzano Na2Zn(OH)4 come inibitore della corrosione per proteggere i metalli dalla corrosione.
Nell’industria farmaceutica, Na2Zn(OH)4 funge da fonte di zinco, un nutriente essenziale per la salute umana. Lo zinco è un elemento essenziale in vari processi biologici, svolgendo un ruolo essenziale nel mantenimento di un sistema immunitario sano e nella promozione della guarigione delle ferite.
Nel complesso, Na2Zn(OH)4 ha una gamma di importanti applicazioni in vari settori ed è un composto versatile con molti potenziali usi.
Domande:
Lo zincato di sodio è un sale?
Lo zincato di sodio è considerato un sale perché forma un composto ionico attraverso la reazione di un metallo (zinco) e una base (idrossido di sodio). Le forze elettrostatiche tengono insieme gli ioni zinco caricati positivamente e gli ioni sodio e idrossido caricati negativamente. I sali sono composti ionici formati dalla reazione tra un acido e una base o un metallo e un non metallo. Sebbene Na2Zn(OH)4 non sia il risultato della reazione di un acido e di una base, soddisfa comunque la definizione generale di sale come composto ionico.
