L’idrazina o N2H4 è un composto incolore e altamente reattivo composto da azoto e idrogeno. È utilizzato come propellente per razzi, in prodotti farmaceutici e chimici agricoli e come agente riducente nelle reazioni chimiche.
| Nome IUPAC | Idrazina |
| Formula molecolare | N2H4 |
| numero CAS | 302-01-2 |
| Sinonimi | Diammina; Diazane; Idruro di azoto; Idrazina anidra; Idrazina anidra; Idrossido di idrazinio; Idrazina idrata; Metilidrazina; Idrazina simmetrica |
| InChI | InChI=1S/H4N2/c1-2/h2H,1H2 |
Struttura di Lewis N2H4:
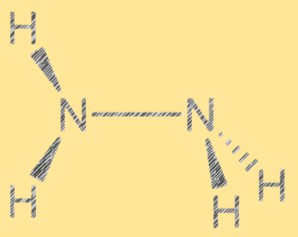
La struttura di Lewis dell’idrazina mostra la disposizione degli elettroni nella molecola. La struttura è costituita da due atomi di azoto, ciascuno con una coppia di elettroni liberi, e quattro atomi di idrogeno. I due atomi di azoto sono uniti da un unico legame covalente e ciascun atomo di azoto è anche legato a due atomi di idrogeno. La struttura di Lewis dell’idrazina aiuta a spiegarne la reattività e le proprietà.
Nome del composto N2H4:
Il nome del composto N2H4 è idrazina. Il nome deriva dal fatto che l’idrazina è un composto contenente atomi di idrogeno e azoto. L’idrazina è conosciuta anche con vari altri nomi, tra cui diammina, diazano e idruro di azoto.
Massa molare N2H4:
La massa molare dell’idrazina, con formula molecolare N2H4, è 32,04 g/mol. È un composto relativamente leggero costituito da due atomi di azoto e quattro atomi di idrogeno. La bassa massa molare dell’idrazina è uno dei motivi per cui viene comunemente utilizzata come carburante per missili, poiché fornisce un elevato rapporto spinta-peso.
Punto di ebollizione dell’idrazina:
L’idrazina ha un punto di ebollizione di 113,5 °C (236,3 °F) a pressione atmosferica. Questo basso punto di ebollizione significa che l’idrazina può facilmente vaporizzare, il che può renderla pericolosa da maneggiare. Quando riscaldata, l’idrazina può decomporsi in gas azoto e idrogeno, il che può anche renderla pericolosa.
Punto di fusione dell’idrazina:
Il punto di fusione dell’idrazina è -51,7 °C (-61,06 °F). Ciò significa che l’idrazina è un liquido a temperatura e pressione ambiente. Il suo basso punto di fusione significa anche che può solidificarsi facilmente a temperature più fredde, il che può renderlo difficile da maneggiare.
Densità dell’idrazina g/ml:
La densità dell’idrazina è 1,00 g/ml a temperatura e pressione ambiente. Ciò significa che l’idrazina è leggermente più densa dell’acqua, che nelle stesse condizioni ha una densità di 1,00 g/ml.
Peso molecolare dell’idrazina:
Il peso molecolare dell’idrazina è 32,04 g/mol. Questo valore viene utilizzato per calcolare la quantità di idrazina necessaria nelle reazioni chimiche e in altre applicazioni.
Struttura dell’idrazina:
La struttura dell’idrazina è costituita da due atomi di azoto legati insieme da un singolo legame covalente, con ciascun atomo di azoto legato anche a due atomi di idrogeno. Ciò conferisce all’idrazina una struttura molecolare simmetrica a forma di V. La struttura dell’idrazina gioca un ruolo importante nella sua reattività e proprietà.
Formula di idrazina:
La formula chimica dell’idrazina è N2H4. Questa formula indica che l’idrazina è composta da due atomi di azoto e quattro atomi di idrogeno. La formula viene utilizzata per rappresentare l’idrazina nelle equazioni e reazioni chimiche.
| Aspetto | Liquido da incolore a giallo pallido |
| Peso specifico | 1,00 g/ml |
| Colore | Incolore |
| Odore | Odore di ammoniaca |
| Massa molare | 32,04 g/mole |
| Densità | 1,00 g/ml |
| Punto di fusione | -51,7°C (-61,06°F) |
| Punto di ebollizione | 113,5°C (236,3°F) |
| Punto flash | 38°C (100°F) |
| solubilità in acqua | Miscibile |
| Solubilità | Solubile in etanolo, etere etilico, cloroformio |
| Pressione del vapore | 72 mmHg a 20°C |
| Densità del vapore | 1.0 (aria=1) |
| pKa | 8 |
| pH | Base (pH > 7) |
Sicurezza e pericoli dell’idrazina
L’idrazina è un composto altamente reattivo e pericoloso che richiede un’attenta manipolazione e conservazione. È tossico e può provocare gravi ustioni a contatto con la pelle, gli occhi o le mucose. L’inalazione di vapori di idrazina può anche causare irritazione respiratoria, danni ai polmoni e, in casi estremi, essere fatale. Anche l’idrazina è infiammabile e può accendersi facilmente, in particolare a contatto con alcuni materiali come gli agenti ossidanti. A causa di questi pericoli, è necessario utilizzare adeguate precauzioni di sicurezza e dispositivi di protezione personale durante la manipolazione dell’idrazina e deve essere utilizzata solo in aree ben ventilate da professionisti qualificati che hanno ricevuto un’adeguata formazione sulla sicurezza.
| Simboli di pericolo | Teschio e ossa incrociate, fiamma |
| Descrizione della sicurezza | Utilizzare solo in aree ben ventilate. Indossare guanti, indumenti e protezioni per gli occhi/il viso. Evitare il contatto con la pelle, gli occhi e gli indumenti. Tenere lontano da fonti di calore, scintille e fiamme. |
| Numeri di identificazione delle Nazioni Unite | ONU 2030 |
| Codice SA | 282510 |
| Classe di pericolo | 6.1 (Sostanze tossiche) |
| Gruppo di imballaggio | II |
| Tossicità | Molto tossico per ingestione, inalazione e contatto con la pelle. Può causare gravi ustioni e danni ai tessuti. L’esposizione a lungo termine può causare danni al fegato e ai reni e può essere potenzialmente cancerogena. |
Metodi di sintesi dell’idrazina
L’idrazina può essere sintetizzata con vari metodi, a seconda della purezza desiderata e dell’applicazione specifica. Alcuni metodi comuni per sintetizzare l’idrazina sono:
- Processo Raschig: questo metodo prevede la reazione di ammoniaca e ipoclorito di sodio in presenza di un catalizzatore come rame o nichel.
- Processo Olin-Raschig: questo processo prevede la reazione di urea e acido cloridrico per produrre idrazina idrata.
- Processo chetazina: questo processo prevede la reazione dell’acetone con l’ammoniaca in presenza di un catalizzatore come il nichel Raney.
- Processo al perossido: questo processo prevede la reazione del perossido di idrogeno e dell’ammoniaca in presenza di un catalizzatore come platino o palladio.
- Processo Bayer: questo processo prevede la reazione dell’ipoclorito di sodio con l’urea in presenza di un catalizzatore come rame o nichel.
- Reazione di Houben-Hoesch: questa reazione prevede la reazione dell’acido nitroso con l’ammoniaca in presenza di un agente riducente come lo zinco.
Ciascun metodo presenta vantaggi e svantaggi e la scelta del metodo dipenderà da fattori quali costo, resa, purezza e considerazioni sulla sicurezza. La sintesi dell’idrazina deve essere eseguita con cautela, poiché l’idrazina è una sostanza pericolosa e può rappresentare un rischio per la salute e la sicurezza umana se non gestita correttamente.
Usi dell’idrazina
N2H4 ha una vasta gamma di applicazioni industriali, commerciali e militari grazie alle sue proprietà chimiche uniche. Alcuni usi comuni di N2H4 includono:
- Le aziende utilizzano N2H4 come carburante per missili a causa del suo elevato contenuto energetico e della sua stabilità.
- N2H4 viene utilizzato come agente di polimerizzazione nella produzione di alcuni polimeri, tra cui nylon e Kevlar.
- I chimici utilizzano N2H4 come agente riducente nelle reazioni di sintesi chimica, in particolare nella produzione di prodotti farmaceutici, pesticidi e altri composti organici.
- N2H4 funziona come agente riducente nei processi di placcatura dei metalli, in particolare per la nichelatura.
- Gli impianti di trattamento dell’acqua utilizzano N2H4 come assorbitore di ossigeno, soprattutto nelle caldaie e nelle torri di raffreddamento.
- I fotografi utilizzano N2H4 come sviluppatore fotografico, in particolare nella fotografia in bianco e nero.
- I produttori di automobili si affidano all’N2H4 come gonfiatore nei sistemi airbag delle automobili.
- Le industrie utilizzano N2H4 come detergente per determinate apparecchiature e superfici, in particolare nell’industria elettronica.
Sebbene l’idrazina abbia molte applicazioni utili, è anche una sostanza pericolosa e deve essere maneggiata con cura. Quando si maneggia l’idrazina devono essere utilizzate precauzioni di sicurezza e dispositivi di protezione individuale adeguati e devono essere utilizzati solo da professionisti qualificati che hanno ricevuto un’adeguata formazione sulla sicurezza.
Domande:
Qual è il numero di ossidazione (stato di ossidazione) di N in N2H4?
In N2H4, il numero di ossidazione (stato di ossidazione) di N è -2. Ogni atomo di idrogeno ha un numero di ossidazione pari a +1 e poiché N2H4 è una molecola neutra, la somma dei numeri di ossidazione di tutti gli atomi deve essere uguale a zero. Poiché in N2H4 sono presenti due atomi di azoto, il numero di ossidazione totale dell’azoto nella molecola è -4. Pertanto, il numero di ossidazione di ciascun atomo di azoto è -2, che bilancia i numeri di ossidazione degli atomi di idrogeno.
Qual è il nome del composto N2H4?
Il composto N2H4 è comunemente chiamato idrazina.
Quali sono i rapporti molari tra idrazina (n2h4) e perossido di idrogeno (h2o2) e tra idrazina e acqua?
I rapporti molari tra idrazina (N2H4) e perossido di idrogeno (H2O2) e tra idrazina e acqua possono essere determinati dalle equazioni chimiche bilanciate delle rispettive reazioni.
Quando l’idrazina reagisce con il perossido di idrogeno, produce gas azoto (N2), acqua (H2O) e ossigeno gassoso (O2) secondo la seguente equazione bilanciata:
N2H4 + H2O2 → N2 + 2H2O + O2
Secondo questa equazione, il rapporto molare tra idrazina e perossido di idrogeno è 1:1. Ciò significa che per ogni mole di idrazina utilizzata nella reazione, viene consumata una mole di perossido di idrogeno.
Quando l’idrazina reagisce con l’acqua, forma idrazina idrato, che ha la formula chimica N2H4·H2O. L’equazione chimica bilanciata per questa reazione è:
N2H4 + H2O → N2H4·H2O
Secondo questa equazione, il rapporto molare idrazina/acqua è 1:1. Ciò significa che per ogni mole di idrazina utilizzata nella reazione, viene consumata una mole di acqua e viene prodotta una mole di idrazina idrato.
