Il benzile o C14H10O2 è un composto organico cristallino giallo utilizzato come precursore nella sintesi di coloranti e come fotoiniziatore nella chimica dei polimeri. Può anche agire come agente riducente ed è un intermedio nella formazione dell’acido benzilico.
| Nome IUPAC | 1,2-difenil-1,2-dicarbossietilene |
| Formula molecolare | C14H10O2 |
| numero CAS | 134-81-6 |
| Sinonimi | 1,2-Difenil-1,2-propandione, 1,2-Difeniletandione, Benzilum, Benzil |
| InChI | InChI=1S/C14H10O2/c15-13(14(16)17)11-6-8-12(9-7-11)10-5-3-1-2-4-6/h1-9H,10- 17H2 |
Peso molecolare del benzile
Il peso molecolare del benzile è 210,24 g/mol. È la somma delle masse atomiche di tutti gli atomi presenti in una molecola di benzile. Il peso molecolare del benzile viene calcolato in base alla sua formula molecolare, C14H10O2.
Densità benzile g/ml
La densità del benzile è 1,20 g/mL. È la misura della massa per unità di volume di una sostanza. La densità del benzile è relativamente bassa, il che lo rende più facile da maneggiare rispetto ad altre sostanze a densità più elevata.
Punto di ebollizione del benzile
Il punto di ebollizione della benzina è 350°C (662°F). È la temperatura alla quale la pressione del vapore di un liquido eguaglia la pressione atmosferica e il liquido si trasforma in vapore. Il punto di ebollizione di una sostanza dipende da vari fattori come la pressione, il peso molecolare e le forze intermolecolari.
Punto di fusione del benzile
Il punto di fusione del benzile è 98°C (270°F). Questa è la temperatura alla quale un solido si trasforma in un liquido. Il punto di fusione del benzile è relativamente basso, rendendolo un utile intermedio nelle sintesi organiche.
Massa molare benzile
La massa molare di C14H10O2 è 210,24 g/mol. È la quantità di sostanza che contiene un numero di entità (ad esempio atomi, molecole, ioni) pari al numero di entità contenute in 12 grammi di carbonio-12 puro. La massa molare del benzile viene calcolata in base alla sua formula molecolare, C14H10O2.
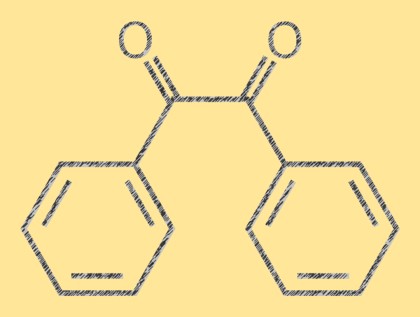
Struttura del benzile
Il benzile è un composto organico cristallino giallo con la formula molecolare C14H10O2. È un dichetone composto da due gruppi fenilici attaccati a un doppio legame carbonio-carbonio centrale. La molecola è planare e il doppio legame è planare. La molecola di benzile ha un caratteristico colore giallo brillante che la rende utile come composto di riferimento in chimica analitica.
Formula benzile
La formula chimica del benzile è C14H10O2. Rappresenta gli elementi costitutivi del benzile e i loro relativi rapporti. La formula mostra che il benzile è costituito da 14 atomi di carbonio, 12 atomi di idrogeno e 2 atomi di ossigeno.
Benzil NMR
C14H10O2 può essere analizzato mediante spettroscopia di risonanza magnetica nucleare (NMR). La spettroscopia NMR è un potente strumento che fornisce informazioni sulla struttura chimica e sulle interazioni delle molecole. Nella spettroscopia NMR, le proprietà magnetiche del nucleo vengono utilizzate per determinare l’ambiente chimico del nucleo e per ottenere informazioni sui legami e sugli spostamenti chimici della molecola. Lo spettro NMR di C14H10O2 fornisce informazioni sul numero di protoni nella molecola e sull’ambiente chimico di ciascun protone, aiutando a confermare la struttura di C14H10O2.
| Aspetto | Solido cristallino giallo |
| Peso specifico | 1,20 g/ml |
| Colore | GIALLO |
| Odore | Inodore |
| Massa molare | 210,24 g/mole |
| Densità | 1,20 g/ml |
| Punto di fusione | 94,8°C |
| Punto di ebollizione | 350°C (662°F) |
| Punto flash | Non disponibile |
| solubilità in acqua | Leggermente solubile in acqua |
| Solubilità | Solubile in etanolo ed etere |
| Pressione del vapore | Non disponibile |
| Densità del vapore | Non disponibile |
| pKa | Non disponibile |
| pH | Non disponibile |
Sicurezza e pericoli del benzile
C14H10O2 è considerata una sostanza moderatamente tossica e deve essere maneggiata con cura. È altamente infiammabile e deve essere tenuto lontano da fonti di calore e scintille. L’inalazione di vapori C14H10O2 può causare irritazione agli occhi, al naso e alla gola e problemi respiratori. Il contatto con la pelle con C14H10O2 può causare irritazione e arrossamento della pelle. L’ingestione di C14H10O2 può causare irritazione allo stomaco e problemi digestivi. Se ingerito in grandi quantità può portare a problemi di salute più gravi come vomito, vertigini e perdita di coscienza. È importante indossare guanti protettivi e protezioni per gli occhi quando si maneggia C14H10O2 e lavorare in un’area ben ventilata per ridurre al minimo l’esposizione. Se si verificano reazioni avverse dopo il contatto con C14H10O2, si consiglia di consultare immediatamente un medico.
| Simboli di pericolo | Infiammabile |
| Descrizione della sicurezza | S24/25 – Evitare il contatto con la pelle e gli occhi |
| Numeri di identificazione delle Nazioni Unite | UN2024 – Merci pericolose, classe di pericolo 3 |
| Codice SA | 2915.90.90 |
| Classe di pericolo | 3 – Liquidi infiammabili |
| Gruppo di imballaggio | III – Rischio moderato |
| Tossicità | Moderatamente tossico |
Metodi di sintesi del benzile
C14H10O2 può essere sintetizzato con vari metodi, inclusi i seguenti:
- Ossidazione del difenilmetanolo: il difenilmetanolo viene ossidato utilizzando triossido di cromo per formare C14H10O2. Questo è un metodo comunemente utilizzato nella sintesi di C14H10O2 perché è semplice ed economico.
- Ossidazione Wacker: questo metodo prevede l’uso di un catalizzatore di palladio e di un ossidante idroperossido per convertire l’alchene in C14H10O2. La reazione viene generalmente condotta in presenza di un solvente, come etanolo o acqua.
- Condensazione di Knoevenagel: in questo metodo, C14H10O2 viene sintetizzato mediante una reazione tra benzaldeide e acido barbiturico in presenza di una base forte come idrossido di sodio o idrossido di potassio.
- Reazione di Ullmann: questo metodo prevede l’accoppiamento di due composti aromatici attraverso una reazione catalizzata dal rame. Nella sintesi di C14H10O2, due molecole di benzaldeide reagiscono per formare C14H10O2.
- Ossidazione Baeyer-Villiger: in questo metodo, C14H10O2 viene sintetizzato ossidando il cicloesanone a C14H10O2 in presenza di un ossidante perossiacido e di una quantità catalitica di un’ammina terziaria.
La scelta del metodo di sintesi C14H10O2 dipende da vari fattori, tra cui la disponibilità delle materie prime, la resa e la purezza desiderate del prodotto, nonché il costo e il tempo coinvolti nel processo di sintesi.
Usi del benzile
C14H10O2 è una sostanza chimica versatile che ha molti usi in vari campi. Alcuni degli usi comuni di C14H10O2 sono:
- La produzione di prodotti chimici fini utilizza C14H10O2 come materia prima nella produzione di vari prodotti chimici fini, inclusi antiossidanti, ritardanti di fiamma e coloranti.
- La sintesi dei polimeri utilizza C14H10O2 nella sintesi di polimeri, inclusi policarbonati e poliuretani, con un’ampia gamma di applicazioni in vari settori.
- I pesticidi utilizzano C14H10O2 come intermedio nella sintesi di alcuni pesticidi per controllare le colture e i parassiti del giardino.
- I cosmetici utilizzano C14H10O2 come fragranza in alcuni prodotti cosmetici come profumi e colonie per fornire un aroma fresco e floreale.
- L’industria degli aromi e delle fragranze utilizza C14H10O2 come ingrediente di aromi e fragranze per conferire un aroma legnoso e floreale ai prodotti alimentari e cosmetici.
In conclusione, C14H10O2 è una sostanza chimica versatile che ha un’ampia gamma di usi in vari settori, tra cui l’industria della chimica fine, farmaceutica e cosmetica.
Domande:
Il benzile è polare?
Sì, C14H10O2 è polare. Ha una struttura molecolare polare dovuta alla presenza di gruppi funzionali polari, come i gruppi carbonile (-C=O) e fenile (-C6H5). Questa struttura polare rende C14H10O2 solubile in solventi polari, come acqua e alcoli, ma insolubile in solventi non polari, come gli idrocarburi. La natura polare di C14H10O2 gli consente inoltre di partecipare a varie reazioni polari, come i legami idrogeno e le interazioni dipolo-dipolo.
Che tipo di reazione avviene la formazione dell’acido benzilico?
La formazione di acido C14H10O2ico da C14H10O2 è un tipo di reazione di riarrangiamento nota come riarrangiamento dell’acido benzilico. Questa reazione è un riarrangiamento del gruppo carbonilico in C14H10O2 per formare un nuovo gruppo funzionale dell’acido carbossilico nell’acido benzilico. Il riarrangiamento dell’acido benzilico è un esempio di riarrangiamento di Beckmann, che è un tipo di reazione di sostituzione nucleofila che coinvolge il riarrangiamento di chetoni ciclici in ammidi o acidi carbossilici. Il meccanismo di reazione prevede la formazione di un intermedio ciclico, seguita dalla migrazione del gruppo carbonilico e dall’eliminazione di un gruppo uscente.
