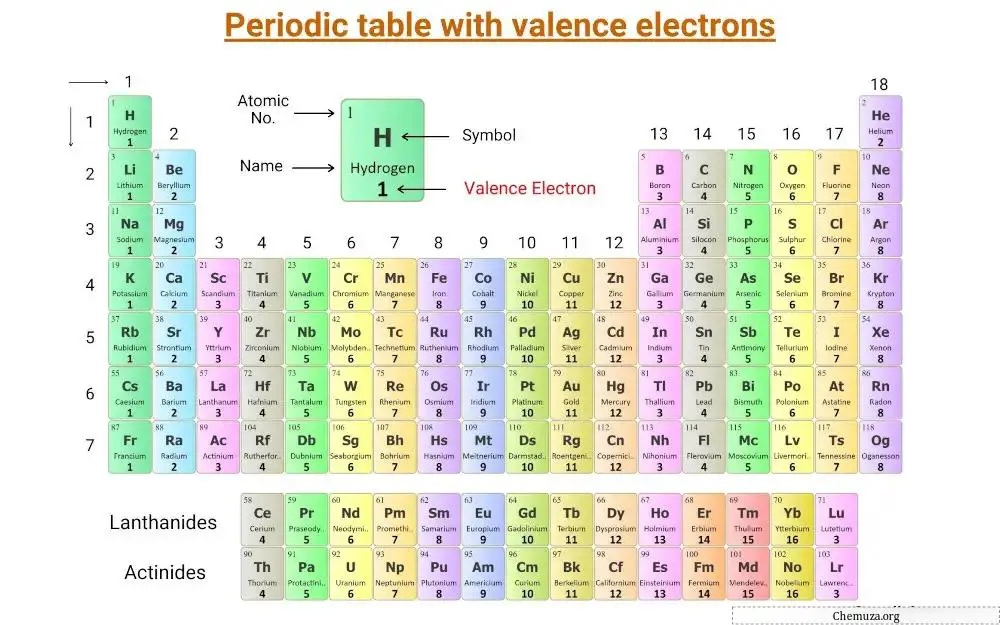
Questa è una tavola periodica su cui sono etichettati gli elettroni di valenza.
Cerchiamo di comprendere il concetto di elettroni di valenza insieme al numero di elettroni di valenza degli elementi del gruppo principale e degli elementi di transizione .
Cosa sono gli elettroni di valenza?
Gli elettroni di valenza sono gli elettroni situati nel guscio più esterno o nel livello energetico di un atomo che sono coinvolti nel legame chimico.
Ad esempio, il magnesio ha 2 elettroni nella sua orbita più esterna, quindi ha 2 elettroni di valenza. [1]
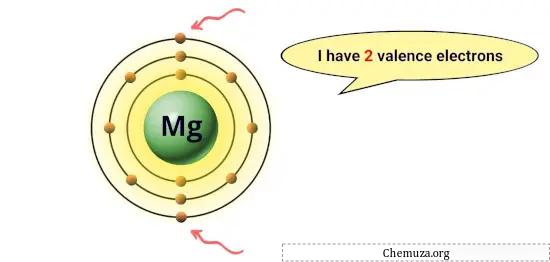
Questi elettroni sono responsabili delle proprietà chimiche di un elemento, come la sua reattività e i tipi di legami chimici che può formare con altri atomi.
Il numero di elettroni di valenza di un atomo determina la sua posizione nella tavola periodica e la sua capacità di formare legami chimici .
Elettroni di valenza degli elementi principali dei gruppi
Gli elementi principali dei gruppi, chiamati anche elementi rappresentativi, si trovano nei gruppi 1, 2 e da 13 a 18 della tavola periodica.
Il numero di elettroni di valenza in questi elementi è uguale al numero del loro gruppo.
Ad esempio, gli elementi del gruppo 1, come il litio e il sodio , hanno un elettrone di valenza, mentre gli elementi del gruppo 2, come il magnesio e il calcio , hanno due elettroni di valenza.
Gli elementi del gruppo 13, come il boro e l’alluminio , hanno tre elettroni di valenza e così via.
Questi elettroni di valenza sono responsabili delle proprietà chimiche e della reattività uniche degli elementi.
Elettroni di valenza di transizione ed elementi di transizione interna
Gli elettroni di valenza degli elementi di transizione e degli elementi di transizione interni sono più complicati da determinare rispetto a quelli degli elementi del gruppo principale.
Infatti, il sottostrato d degli elementi di transizione e il sottostrato f degli elementi di transizione interni sono riempiti in modo incompleto e sono molto vicini al sottostrato esterno s.
Di conseguenza, gli elettroni dei sottolivelli d ed s negli elementi di transizione e dei sottolivelli f ed s negli elementi di transizione interni possono comportarsi come elettroni di valenza.
Per gli elementi di transizione, gli elettroni di valenza possono variare da 3 a 12 a causa del contributo degli elettroni del subshell d e del subshell s. In alcuni casi, anche gli elettroni negli orbitali d incompleti sono considerati elettroni di valenza. [2]
Allo stesso modo, per gli elementi di transizione interni (o elementi del blocco f), gli elettroni di valenza possono variare da 3 a 16 a causa del contributo degli elettroni del subshell f e del subshell s. [3] Gli elettroni negli orbitali d incompleti possono anche essere considerati elettroni di valenza in alcuni metalli di transizione interna.
È importante notare che per gli elementi di transizione e di transizione interna, gli elettroni di valenza sono gli elettroni presenti nei gusci esterni al nucleo di gas nobile.
