Il carbonato di sodio o carbonato di sodio è un composto inorganico con la formula chimica Na2CO3. È un sale alcalino, di colore bianco e solubile in acqua. Viene utilizzato in molti processi industriali e commerciali, come nella produzione di vetro, carta, saponi, detersivi e prodotti per la pulizia.
| Nome IUPAC | Carbonato di sodio |
| Formula molecolare | Na2CO3 |
| numero CAS | 497-19-8 |
| Sinonimi | Na2CO3 anidro, Na2CO3 decaidrato, bicarbonato di sodio, carbonato di sodio |
| InChI | InChI=1S/2Na.CO3/c21-3(2)4;/h2(H,1,2,3,4);/q;;+2/p-2 |
Proprietà del carbonato di sodio
Massa molare del carbonato di sodio
La massa molare del carbonato di sodio è 106,0 g/mol. È la somma delle masse atomiche di tutti gli atomi in una molecola di carbonato di sodio. La massa molare è un’importante proprietà fisica utilizzata in molti calcoli in chimica e in altre scienze.
Punto di ebollizione del carbonato di sodio
Il carbonato di sodio ha un punto di ebollizione di 1600°C. Questa è la temperatura alla quale la pressione del vapore del liquido è uguale alla pressione dell’atmosfera circostante e il liquido bolle. Il punto di ebollizione è una proprietà utile per identificare e separare diversi composti.
Punto di fusione del carbonato di sodio
Na2CO3 ha un punto di fusione di 851°C. Questa è la temperatura alla quale la forma solida del composto si trasforma in liquida. Il punto di fusione è una proprietà importante utilizzata per l’identificazione e la purificazione di diverse sostanze.
Densità del carbonato di sodio g/ml
Na2CO3 ha una densità di 2,54 g/mL. La densità è definita come la massa per unità di volume di una sostanza ed è una proprietà utile per determinare la concentrazione di una soluzione.
Peso molecolare del carbonato di sodio
Il peso molecolare del carbonato di sodio è 106 g/mol. È la somma dei pesi atomici di tutti gli atomi di una molecola. Il peso molecolare è una proprietà importante utilizzata in molti calcoli in chimica e in altre scienze.
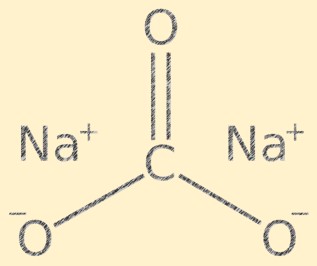
Struttura del carbonato di sodio
Na2CO3 ha una struttura cristallina ed è composto da cationi sodio (Na+) e anioni carbonato (CO3-). Lo ione carbonato ha una forma planare trigonale, con l’atomo di carbonio al centro e gli atomi di ossigeno ad esso attaccati con un angolo di 120 gradi. Gli ioni sodio e gli ioni carbonato sono tenuti insieme da legami ionici, conferendo al composto la sua caratteristica struttura cristallina.
| Aspetto | Polvere cristallina bianca o piccoli cristalli bianchi |
| Peso specifico | 2,54 g/cm³ |
| Colore | Bianco |
| Odore | Inodore |
| Massa molare | 106,0 g/mole |
| Densità | 2,54 g/ml |
| Punto di fusione | 851°C |
| Punto di ebollizione | 1600°C |
| Punto flash | Non applicabile |
| solubilità in acqua | Solubile in acqua |
| Solubilità | Solubile in glicerolo, leggermente solubile in etanolo |
| Pressione del vapore | Non disponibile |
| Densità del vapore | Non disponibile |
| pKa | 10.3 |
| pH | 11.6 (soluzione 1M) |
Sicurezza e pericoli del carbonato di sodio
Il carbonato di sodio è un composto basico e può causare irritazione alla pelle e agli occhi. L’inalazione delle sue polveri può causare irritazioni alle vie respiratorie. È nocivo anche se ingerito e può causare disturbi digestivi. La manipolazione deve essere effettuata con guanti e occhiali protettivi e la sostanza deve essere conservata in un luogo fresco e asciutto, lontano da fonti di ignizione. Evitare di ingerire o inalare la polvere e lavarsi accuratamente dopo averla maneggiata.
| Simboli di pericolo | XI, n |
| Descrizione della sicurezza | Irritante |
| Numeri di identificazione delle Nazioni Unite | Un 1824 |
| Codice SA | 2836.90.90 |
| Classe di pericolo | 8 |
| Gruppo di imballaggio | III |
| Tossicità | LD50 orale (ratto) = 915 mg/kg. LC50 per inalazione (ratto) = >10 mg/L/4h. Può causare irritazione alla pelle e agli occhi, irritazione delle vie respiratorie se inalato. Può essere nocivo se ingerito. |
Metodi per la sintesi del carbonato di sodio
Il carbonato di sodio può essere sintetizzato mediante due metodi principali: il processo Solvay e il metodo di precipitazione. Il processo Solvay, noto anche come processo ammoniaca-soda, prevede la reazione di cloruro di sodio, ammoniaca e anidride carbonica per produrre carbonato di sodio, cloruro di ammonio e acqua. Il metodo di precipitazione prevede la reazione di idrossido di sodio e anidride carbonica per produrre carbonato di sodio e acqua. Entrambi i metodi danno come risultato un prodotto ad elevata purezza che può essere utilizzato per varie applicazioni come il trattamento dell’acqua, la produzione di saponi e detergenti e la produzione di vetro. Il processo Solvay è il metodo più comunemente utilizzato grazie al suo costo di produzione inferiore e alla maggiore resa produttiva.
Usi del carbonato di sodio
Le industrie utilizzano il carbonato di sodio o il bicarbonato di sodio per vari scopi. L’industria dei detersivi lo utilizza come addolcitore dell’acqua e regolatore del pH, l’industria del vetro lo utilizza per creare vetro piano, vetro da imballaggio e vetro speciale, e l’industria della carta lo utilizza per neutralizzare i flussi di rifiuti acidi e regolare il pH. Nell’industria chimica, il carbonato di sodio è un ingrediente chiave nella produzione di silicati e bicarbonati di sodio. Serve anche come additivo alimentare e detergente nelle caldaie e nei processi di trattamento dell’acqua nell’industria alimentare. Inoltre, il carbonato di sodio svolge un ruolo nella produzione di coloranti, smalti, ceramiche e funge da estintore negli estintori.
