Il fluoruro di nichel (NiF2) è un composto chimico. È composto da atomi di nichel e fluoro. Utilizzato in varie applicazioni tra cui batterie e galvanica grazie alle sue proprietà uniche.
| Nome IUPAC | Fluoruro di nichel (II). |
| Formula molecolare | NiF2 |
| numero CAS | 10028-18-9 |
| Sinonimi | Difluoruro di nichel, fluoruro di nichel, difluoronichel |
| InChI | InChI=1S/2FH.Ni/h2*1H;/q;;+2/p-2 |
Proprietà del fluoruro di nichel
Formula del fluoruro di nichel
La formula chimica del difluoruro di nichel è NiF2. Ciò significa che ciascuna molecola di difluoruro di nichel è costituita da un atomo di nichel e due atomi di fluoro legati insieme.
Massa molare del fluoruro di nichel
Il difluoruro di nichel ha una massa molare di circa 96,69 grammi per mole. Questo valore si calcola sommando le masse atomiche di un atomo di nichel (58,69 g/mol) e due atomi di fluoro (18,998 g/mol ciascuno).
Punto di ebollizione del fluoruro di nichel
Il punto di ebollizione del difluoruro di nichel è relativamente alto, intorno a 1.568 gradi Celsius (2.854 gradi Fahrenheit). Questa temperatura rappresenta il punto in cui il difluoruro di nichel passa dalla fase liquida allo stato gassoso.
Fluoruro di nichel Punto di fusione
Il difluoruro di nichel ha un punto di fusione di circa 1.372 gradi Celsius (2.502 gradi Fahrenheit). Questa è la temperatura alla quale il difluoruro di nichel solido si trasforma in liquido.
Densità del fluoruro di nichel g/mL
La densità del difluoruro di nichel è di circa 4,72 grammi per centimetro cubo (g/cm³). Questo valore di densità fornisce una panoramica della densità delle particelle in un dato volume della sostanza.
Peso molecolare del fluoruro di nichel
Il peso molecolare del difluoruro di nichel è di circa 96,69 grammi per mole. Viene determinato aggiungendo i pesi atomici dei suoi elementi costitutivi nella formula chimica NiF2.
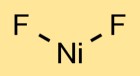
Struttura del fluoruro di nichel
Il difluoruro di nichel ha una struttura cristallina. L’atomo di nichel è al centro, legato a due atomi di fluoro. La disposizione degli atomi dà origine ad uno schema ripetuto, formando un reticolo cristallino.
Solubilità del fluoruro di nichel
Il difluoruro di nichel è scarsamente solubile in acqua. La sua solubilità è influenzata da fattori quali la temperatura e la presenza di altre sostanze. Quando si dissolve, si dissocia negli ioni Ni+2 e F- nella soluzione acquosa.
| Aspetto | Solido cristallino verde |
| Peso specifico | 4,72 g/cm³ |
| Colore | Verde |
| Odore | Inodore |
| Massa molare | 96,69 g/mole |
| Densità | 4,72 g/cm³ |
| Punto di fusione | 1372°C (2502°F) |
| Punto di ebollizione | 1.568°C (2.854°F) |
| Punto flash | Non applicabile |
| solubilità in acqua | Scarsamente solubile |
| Solubilità | Si dissolve in acqua, si dissocia in ioni nichel e ioni fluoruro |
| Pressione del vapore | Non ben definito |
| Densità del vapore | Non ben definito |
| pKa | Non applicabile |
| pH | Non applicabile |
Sicurezza e pericoli del fluoruro di nichel
Il difluoruro di nichel presenta potenziali rischi per la sicurezza. Può causare irritazione alla pelle e agli occhi al contatto. L’inalazione delle sue polveri o dei suoi fumi può causare irritazione respiratoria. L’esposizione prolungata potrebbe portare a effetti più gravi sulla salute. Quando si maneggia il difluoruro di nichel devono essere utilizzate misure protettive adeguate, inclusi guanti e occhiali di sicurezza. Gli spazi di lavoro devono essere ben ventilati per ridurre al minimo il rischio di inalazione. In caso di ingestione o contatto accidentale è necessario l’intervento del medico. È necessario considerare anche il potenziale impatto ambientale del difluoruro di nichel e il suo smaltimento deve seguire le normative appropriate per evitare la contaminazione.
| Simboli di pericolo | Dannoso per la salute |
| Descrizione della sicurezza | Provoca irritazione alla pelle e agli occhi. Nocivo se inalato o ingerito. L’esposizione prolungata può causare effetti più gravi sulla salute. Maneggiare con adeguati dispositivi di protezione. Evitare l’inalazione e il contatto. |
| Numeri di identificazione delle Nazioni Unite | Non attribuito |
| Codice SA | 2826.20.1000 |
| Classe di pericolo | 6.1 (Sostanze tossiche) |
| Gruppo di imballaggio | III |
| Tossicità | Moderatamente tossico |
Metodi per la sintesi del fluoruro di nichel
Il difluoruro di nichel può essere sintetizzato con vari metodi. Un approccio comune prevede la reazione tra ossido di nichel (NiO) o carbonato di nichel (NiCO3) con acido fluoridrico (HF):
- Reazione con acido fluoridrico :
- Metodo all’ossido di nichel (NiO): NiO + 2 HF → NiF2 + H2O
- Metodo con carbonato di nichel (NiCO3): NiCO3 + 4 HF → NiF2 + CO2 + 2 H2O
Un altro metodo utilizza la reazione tra cloruro di nichel (NiCl2) e fluoruro di ammonio (NH4F):
- Reazione con fluoruro di ammonio : NiCl2 + 2 NH4F → NiF2 + 2 NH4Cl
Inoltre, il difluoruro di nichel può essere ottenuto dalla reazione dell’ossido di nichel con fluoruro di ammonio:
- Reazione con fluoruro di ammonio (metodo all’ossido di nichel) : NiO + 2 NH4F → NiF2 + 2 H2O + (NH4)2O
Questi metodi generalmente avvengono a temperature e condizioni controllate per garantire la corretta sintesi e la purezza del prodotto. È essenziale maneggiare l’acido fluoridrico e gli altri reagenti con cautela a causa dei loro potenziali pericoli. Il difluoruro di nichel risultante può essere purificato e lavorato per varie applicazioni, come materiali per batterie e galvanica.
Usi del fluoruro di nichel
Il difluoruro di nichel (NiF2) trova varie applicazioni grazie alle sue proprietà uniche. Serve in vari settori per scopi distinti:
- Tecnologia delle batterie: utilizzata come componente nelle batterie agli ioni di litio, migliorandone le prestazioni e la stabilità.
- Galvanotecnica: utilizzata nei processi di galvanica per creare rivestimenti di nichel durevoli e resistenti alla corrosione su vari materiali.
- Catalisi: agisce come catalizzatore in alcune reazioni chimiche, aiutando nella sintesi di prodotti preziosi.
- Vetro e ceramica: Incorporati nella produzione di vetro e ceramica speciali, migliorandone le proprietà e le caratteristiche.
- Fluorizzazione: utilizzata per la fluorizzazione dell’acqua per migliorare la salute dentale prevenendo la carie.
- Produzione chimica: funge da precursore nella sintesi di altri composti e prodotti chimici del nichel.
- Condensatori ceramici: presenti nella produzione di condensatori ceramici utilizzati in elettronica e telecomunicazioni.
- Prodotti farmaceutici: utilizzati come reagenti in alcuni processi e ricerche farmaceutiche.
- Fotografia: storicamente utilizzato nell’industria fotografica come componente di alcuni sviluppatori fotografici.
- Additivo per leghe metalliche: aggiunto a determinate leghe metalliche per migliorarne le proprietà quali resistenza e tenacità.
Le caratteristiche adattabili del difluoruro di nichel lo rendono una risorsa preziosa in un’ampia gamma di settori, contribuendo ai progressi nella tecnologia, nella sanità e nella produzione.
Domande:
D: Quali sono i prodotti sui due elettrodi durante l’elettrolisi di una soluzione NiF2(aq)?
R: Al catodo si forma nichel metallico (Ni), mentre all’anodo si sviluppa fluoro gassoso (F2).
D: Cosa produce l’elettrolisi NiF2?
R: Il nichel metallico viene prodotto al catodo e il fluoro gassoso si sviluppa all’anodo durante l’elettrolisi di NiF2.
D: Il composto NiF2 è un composto ionico. Quali sono gli ioni che lo compongono?
R: NiF2 è composto da ioni nichel (Ni²⁺) e ioni F-.
D: Che tipo di reazione è Ni(s) + F2 —> NiF2(s)?
R: La reazione Ni(s) + F2 → NiF2(s) è una reazione di combinazione (sintesi).
D: Qual è il nome del composto con la formula NiF2?
R: Il composto con la formula NiF2 è chiamato difluoruro di nichel (II).
D: Dove viene utilizzato il fluoruro di nichel (II)?
R: Il difluoruro di nichel (II) viene utilizzato nella tecnologia delle batterie, nella galvanica, nei catalizzatori e nella produzione di ceramica.
D: Qual è la formula del fluoruro di nichel (II)?
R: La formula del difluoruro di nichel (II) è NiF2.
D: Il fluoruro di nichel (II) e l’idrossido di sodio precipitano?
R: Sì, precipitano sotto forma di un solido verde, idrossido di nichel (II).
D: Il fluoruro di nichel conduce l’elettricità?
R: Sì, il difluoruro di nichel può condurre elettricità allo stato fuso o quando disciolto in acqua.
D: Il fluoruro di nichel fuso o la grafite sono più conduttivi?
R: Il difluoruro di nichel fuso è più conduttivo della grafite grazie alla sua natura ionica e agli ioni mobili.
