Il fluoruro di zinco (ZnF2) è un composto chimico. È composto da zinco e fluoro. È utilizzato in vari settori come quello dentale ed elettronico grazie alle sue proprietà uniche.
| Nome IUPAC | Fluoruro di zinco |
| Formula molecolare | ZnF2 |
| numero CAS | 7783-49-5 |
| Sinonimi | Difluoruro di zinco, fluoruro di zinco (II). |
| InChI | InChI=1S/2FH.Zn/h2*1H;/q;;+2/p-2 |
Proprietà del fluoruro di zinco
Formula al fluoruro di zinco
La formula chimica del difluoruro di zinco è ZnF2. Questa formula significa che ciascuna molecola di difluoruro di zinco è costituita da un atomo di zinco (Zn) e due atomi di fluoro (F).
Massa molare del fluoruro di zinco
La massa molare del difluoruro di zinco (ZnF2) è di circa 103,38 g/mol. Questo valore viene calcolato sommando le masse atomiche di un atomo di zinco e due atomi di fluoro.
Punto di ebollizione del fluoruro di zinco
Il difluoruro di zinco ha un punto di ebollizione di circa 872°C (1602°F). Questa è la temperatura alla quale il composto passa da liquido a gassoso sotto la pressione atmosferica standard.
Fluoruro di zinco Punto di fusione
Il punto di fusione del difluoruro di zinco è di circa 872°C (1602°F). A questa temperatura, la forma solida del difluoruro di zinco si trasforma in un liquido.
Densità del fluoruro di zinco g/mL
La densità del difluoruro di zinco è di circa 4,95 g/mL. Questo valore rappresenta la massa del composto per unità di volume e ne indica la pesantezza.
Peso molecolare del fluoruro di zinco
Il peso molecolare del difluoruro di zinco (ZnF2) è di circa 103,38 g/mol. Questo valore rappresenta la somma dei pesi atomici di tutti gli atomi presenti in una molecola del composto.
Struttura del fluoruro di zinco
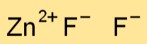
Il difluoruro di zinco (ZnF2) ha una struttura cristallina in cui ciascun atomo di zinco è circondato da quattro ioni fluoruro disposti in una disposizione tetraedrica. Questa disposizione contribuisce alla stabilità del composto.
Solubilità del fluoruro di zinco
Il difluoruro di zinco dimostra una solubilità limitata in acqua. È scarsamente solubile, il che significa che solo una piccola quantità del composto può dissolversi in acqua per formare una soluzione. Questa caratteristica è importante per varie applicazioni industriali e processi chimici.
| Aspetto | Solido bianco |
| Peso specifico | 4,95 g/cm³ |
| Colore | Incolore |
| Odore | Inodore |
| Massa molare | 103,38 g/mole |
| Densità | 4,95 g/ml |
| Punto di fusione | 872°C (1602°F) |
| Punto di ebollizione | 872°C (1602°F) |
| Punto flash | Non applicabile |
| solubilità in acqua | Solubilità limitata |
| Solubilità | Scarsamente solubile, solo una piccola quantità può dissolversi in acqua |
| Pressione del vapore | Non ben definito |
| Densità del vapore | Non ben definito |
| pKa | Non applicabile |
| pH | Neutro |
Sicurezza e pericoli del fluoruro di zinco
Il difluoruro di zinco (ZnF2) pone alcune considerazioni sulla sicurezza. È importante maneggiare questo composto con cura. Evitare l’inalazione o l’ingestione poiché ciò potrebbe causare irritazione respiratoria e gastrointestinale. Quando si lavora con ZnF2, indossare adeguati dispositivi di protezione individuale come guanti e occhiali di sicurezza per evitare il contatto con la pelle e gli occhi. In caso di contatto accidentale, sciacquare le zone interessate con abbondante acqua. Conservare il difluoruro di zinco lontano da materiali incompatibili e fonti di calore. Sebbene non sia molto tossico, è consigliabile seguire le corrette procedure di manipolazione e garantire una buona ventilazione per ridurre al minimo i potenziali rischi associati al suo utilizzo.
| Simboli di pericolo | Corrosivo, irritante, tossico acuto |
| Descrizione della sicurezza | Maneggiare con cura. Evitare l’inalazione e l’ingestione. Indossare dispositivi di protezione. |
| Numeri di identificazione delle Nazioni Unite | Non applicabile |
| Codice SA | 28261900 |
| Classe di pericolo | Non classificato |
| Gruppo di imballaggio | Non applicabile |
| Tossicità | Bassa tossicità |
Metodi per la sintesi del fluoruro di zinco
Il difluoruro di zinco può essere sintetizzato con vari metodi. Un approccio comune prevede la reazione tra ossido di zinco (ZnO) e acido fluoridrico (HF) . In questo metodo, ZnO viene miscelato con HF, determinando la formazione di difluoruro di zinco e acqua. Un altro metodo prevede la reazione tra carbonato di zinco (ZnCO3) e acido fluoridrico. Il carbonato di zinco reagisce con l’HF per produrre difluoruro di zinco, anidride carbonica e acqua.
Inoltre, il difluoruro di zinco può essere preparato anche facendo reagire lo zinco metallico con il fluoro gassoso (F2) ad alte temperature. Questa reazione produce direttamente difluoruro di zinco con rilascio di calore.
Inoltre, si possono utilizzare metodi di precipitazione, in cui i sali di zinco solubili reagiscono con i sali di fluoruro solubili per formare difluoruro di zinco insolubile, che può quindi essere separato e raccolto.
È importante prestare attenzione durante questi processi di sintesi a causa della reattività delle sostanze chimiche coinvolte. È necessario utilizzare misure e attrezzature di sicurezza adeguate per garantire la sintesi sicura e riuscita del difluoruro di zinco.
Usi del fluoruro di zinco
Il difluoruro di zinco (ZnF2) trova applicazioni versatili in vari settori grazie alle sue proprietà uniche. Ecco i suoi principali utilizzi:
- Cure dentistiche: rafforza lo smalto dei denti e migliora l’igiene orale incorporando ZnF2 nelle formulazioni dei dentifrici.
- Ottiche e rivestimenti: migliorano le proprietà antiriflesso delle lenti e migliorano la trasmissione della luce utilizzando ZnF2 nei rivestimenti ottici.
- Elettronica: integrazione di ZnF2 nei display TFT (thin film transistor) per creare pellicole conduttive trasparenti.
- Sorgente di ioni di fluoruro: utilizzare ZnF2 come sorgente di ioni di fluoruro nelle celle elettrolitiche per contribuire a produrre metalli reattivi come l’alluminio.
- Sintesi chimica: utilizzare ZnF2 come catalizzatore e agente fluorurante in varie reazioni chimiche per facilitare la sintesi di prodotti farmaceutici e agrochimici.
- Galvanizzazione: applicare ZnF2 nei processi di finitura dei metalli su superfici metalliche pronte per essere zincate, migliorando l’adesione e la durata.
- Finestre a infrarossi: realizza finestre con sensori a infrarossi e sistemi di imaging termico utilizzando ZnF2 grazie alla sua trasparenza nella regione dell’infrarosso.
- Applicazioni laser: utilizzare ZnF2 come mezzo di guadagno laser per contribuire allo sviluppo di laser sintonizzabili per scopi scientifici e industriali.
- Crescita dei cristalli: incorporare ZnF2 nei processi di crescita dei cristalli per semiconduttori e altri componenti elettronici.
- Ricerca chimica: utilizza ZnF2 come reagente e reagente in varie reazioni chimiche su scala di laboratorio, facilitando l’esplorazione di nuovi composti.
Queste diverse applicazioni evidenziano l’importanza del difluoruro di zinco nella tecnologia moderna, nella produzione e nella ricerca scientifica in molteplici campi.
Domande:
D: Qual è la formula chimica del fluoruro di zinco?
R: La formula chimica del difluoruro di zinco è ZnF2.
D: Qual è la formula del fluoruro di zinco (II)?
R: La formula del difluoruro di zinco (II) è ZnF2.
D: Qual è la formula del composto ionico formato da ioni zinco e fluoruro?
R: La formula del composto ionico formato da Zn+2 e ioni fluoruro è ZnF2.
D: Cosa può succedere a causa di carenze di zinco, iodio o fluoro?
R: Le carenze di zinco, iodio o fluoro possono portare a una serie di problemi di salute, influenzando il metabolismo, la funzione tiroidea e la salute dentale.
D: Quale dei seguenti non ha una RDA? A. ferro B. zinco c. iodio d. fluoruro
R: Il fluoro non prevede una dose giornaliera raccomandata (RDA).
D: In che modo il fluoruro di zinco può influenzare un essere umano?
R: Il difluoruro di zinco può avere effetti sull’uomo attraverso l’ingestione, l’inalazione o il potenziale contatto con la pelle, causando eventualmente irritazione o tossicità.
D: ZnF2 è ionico o molecolare?
R: ZnF2 è un composto ionico.
D: Perché è ZnF2 e non ZnF?
R: ZnF2 indica che ciascun atomo di Zn è legato a due ioni F, formando la stechiometria corretta.
D: ZnF2 e NaOH formeranno un precipitato?
R: Sì, ZnF2 e NaOH possono formare un precipitato bianco di idrossido di zinco (Zn(OH)2).
D: Lo ZnF2 è solubile?
R: ZnF2 è scarsamente solubile in acqua.
D: Qual è il nome del composto con la formula ZnF2?
R: Il composto con la formula ZnF2 è chiamato difluoruro di zinco.
D: La Ksp di ZnF2 è 3,0 × 10⁻² a 25°C. Cos’è ΔG°?
R: Il valore di ΔG° può essere calcolato in base al valore Ksp e alla temperatura forniti utilizzando l’equazione termodinamica appropriata.
D: Cos’è ZnF2?
R: ZnF2 è la formula chimica del difluoruro di zinco, un composto di zinco e fluoro.
D: Quante moli ci sono in ZnF2?
R: Il numero di moli in ZnF2 dipende dalla massa data e dalla massa molare del composto.
