Il bromuro di rame (CuBr2) è un composto costituito da rame e bromo. Presenta un colore blu-verde, spesso utilizzato nella sintesi organica e come catalizzatore dell’acido di Lewis.
| Nome IUPAC | Bromuro di rame(II). |
| Formula molecolare | CuBr2 |
| numero CAS | 7789-45-9 |
| Sinonimi | Bromuro rameico, dibromuro di rame |
| InChI | InChI=1S/Br2.Cu |
Proprietà del bromuro di rame
Formula del bromuro di rame
La formula del bromuro rameico è CuBr2. Rappresenta un composto formato da un atomo di rame e due atomi di bromo. Questa combinazione si traduce in una sostanza cristallina blu-verde, comunemente usata in varie reazioni chimiche.
Massa molare del bromuro di rame
La massa molare del bromuro rameico è di circa 223,36 grammi per mole. Questo valore si ottiene sommando le masse atomiche di un atomo di rame (Cu) e due atomi di bromo (Br) presenti nella formula CuBr2.
Punto di ebollizione del bromuro di rame
Il bromuro rameico ha un punto di ebollizione di circa 1.294 gradi Celsius (circa 2.361 gradi Fahrenheit). Questa temperatura indica il punto in cui la sostanza passa dallo stato liquido a quello gassoso sotto la pressione atmosferica standard.
Punto di fusione del bromuro di rame
Il punto di fusione del bromuro rameico è di circa 498 gradi Celsius (circa 928 gradi Fahrenheit). Questa temperatura rappresenta il punto in cui la sostanza solida passa allo stato liquido quando riscaldata.
Densità del bromuro di rame g/mL
La densità del bromuro rameico è di circa 4,71 grammi per millilitro (g/ml) a temperatura ambiente e pressione atmosferica standard. Questo valore rivela la quantità di massa presente per unità di volume della sostanza.
Peso molecolare del bromuro di rame
Il bromuro rameico ha un peso molecolare di circa 223,36 grammi per mole. Questo valore è cruciale per vari calcoli chimici e serve come riferimento per la quantità di sostanza presente in un dato campione.
Struttura del bromuro di rame
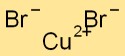
Il bromuro rameico ha una struttura reticolare cristallina in cui gli atomi di rame sono circondati da atomi di bromo e viceversa. Questa disposizione forma uno schema stabile e ordinato, contribuendo alle proprietà fisiche del composto.
Solubilità del bromuro di rame
Il bromuro rameico ha una solubilità limitata in acqua. È più solubile nei solventi organici. La solubilità dipende da fattori quali la temperatura e la natura del solvente utilizzato. Comprenderne la solubilità è vitale per varie applicazioni in chimica e nell’industria.
| Aspetto | Cristalli blu-verdi |
| Peso specifico | Non disponibile |
| Colore | Blu verde |
| Odore | Inodore |
| Massa molare | 223,36 g/mole |
| Densità | 4,71 g/ml |
| Punto di fusione | 498°C (928°F) |
| Punto di ebollizione | 1294°C (2361°F) |
| Punto flash | Non applicabile |
| solubilità in acqua | Solubilità limitata |
| Solubilità | Solubile in solventi organici come etanolo, etere e benzene |
| Pressione del vapore | Non disponibile |
| Densità del vapore | Non disponibile |
| pKa | Non disponibile |
| pH | Non disponibile |
Sicurezza e pericoli del bromuro di rame
Il bromuro rameico pone alcune considerazioni sulla sicurezza e sui rischi. È essenziale maneggiare questo composto con cautela a causa della sua potenziale tossicità e proprietà irritanti. Il contatto diretto con la pelle o gli occhi può causare irritazione e disagio. L’inalazione delle sue polveri o dei suoi fumi può irritare le vie respiratorie. Pertanto, quando si lavora con il bromuro rameico è necessario indossare dispositivi di protezione individuale adeguati, come guanti e occhiali protettivi. Inoltre, dovrebbe essere conservato lontano da sostanze incompatibili per evitare potenziali reazioni. In caso di ingestione o esposizione accidentale consultare immediatamente un medico. Il rispetto delle precauzioni di sicurezza è fondamentale per garantire la manipolazione e l’uso sicuri del bromuro rameico.
| Simboli di pericolo | Irritante, Corrosivo |
| Descrizione della sicurezza | Maniglia con cauzione. Evitare il contatto diretto con la pelle e gli occhi. Utilizzare dispositivi di protezione adeguati. |
| Numeri di identificazione delle Nazioni Unite | Non disponibile |
| Codice SA | Non disponibile |
| Classe di pericolo | Irritante |
| Gruppo di imballaggio | Non disponibile |
| Tossicità | Può causare irritazione alla pelle e agli occhi. L’inalazione di polveri o fumi può irritare le vie respiratorie. |
Metodi per la sintesi del bromuro di rame
Esistono diversi metodi per sintetizzare il bromuro rameico (CuBr2). Un approccio comune prevede la combinazione diretta di rame metallico o ossido di rame con acido bromidrico . In questo metodo aggiungiamo rame all’acido e questo subisce una reazione chimica che porta alla formazione di bromuro rameico e al rilascio di gas idrogeno.
Un altro metodo è la reazione tra carbonato di rame o idrossido di rame con acido bromidrico. Il carbonato o l’idrossido reagisce con l’acido per produrre bromuro rameico, acqua e anidride carbonica.
Inoltre, per sintetizzare il bromuro rameico, è possibile utilizzare una reazione a doppio spostamento. Questo metodo prevede la reazione tra un sale di rame solubile, come il solfato di rame, e un sale di bromuro solubile, come il bromuro di sodio. La reazione porta alla formazione di bromuro rameico e di un sale solubile dell’altro metallo o metalloide presente nella reazione.
Inoltre, per sintetizzare il bromuro rameico, possiamo utilizzare metodi elettrochimici. Questi metodi prevedono l’uso di una cella elettrochimica con elettrodi di rame e una sorgente di ioni bromuro. Quando applichiamo una corrente, su un elettrodo si forma bromuro rameico, mentre sull’altro elettrodo viene rilasciato gas di bromo.
La scelta del metodo di sintesi dipende da fattori quali la disponibilità dei reagenti, la purezza desiderata e l’entità della reazione. Durante tutte le procedure di sintesi è necessario osservare una corretta manipolazione e le precauzioni di sicurezza.
Usi del bromuro di rame
Il bromuro di rame (CuBr2) trova applicazioni versatili in vari settori grazie alle sue proprietà uniche. Ecco alcuni dei suoi usi notevoli:
- Sintesi organica : il bromuro rameico funge da catalizzatore in molte reazioni organiche, come l’accoppiamento di Ullmann e la reazione di Wurtz-Fittig, consentendo la formazione di legami carbonio-carbonio e carbonio-eteroatomo.
- Fotografia : viene utilizzato nei processi fotografici per sensibilizzare le emulsioni e migliorare la sensibilità di pellicole e lastre, facilitando così la cattura di immagini di alta qualità.
- Galvanotecnica : il bromuro di rame viene utilizzato nei processi di galvanica per depositare strati di rame sulle superfici, fornendo resistenza alla corrosione e finiture decorative.
- Industria dei semiconduttori : nel settore elettronico, viene utilizzato nella sintesi di nanocristalli a base di bromuro rameico, che hanno applicazioni nell’optoelettronica e nella fotonica.
- Colorante per fiamma : il bromuro di rame viene utilizzato negli articoli pirotecnici e nei fuochi d’artificio per produrre un colore verde della fiamma, aggiungendo fascino visivo agli spettacoli.
- Medicina : sebbene limitata, è stata esplorata per potenziali applicazioni terapeutiche grazie alle sue proprietà antibatteriche.
- Tecnologia laser : i laser al bromuro di rame sono utilizzati nella ricerca scientifica, negli studi sulla fluorescenza indotta dal laser e per generare impulsi laser ad alta energia.
- Analisi chimica : viene utilizzato in chimica analitica per analisi qualitative e quantitative.
- Reazioni di bromurazione : il bromuro rameico agisce come agente di bromurazione, facilitando l’aggiunta di bromo ai composti organici.
- Litografia : nei processi litografici, i composti del bromuro di rame sono stati studiati per l’uso nelle tecniche di micro e nanofabbricazione.
Le varie applicazioni del bromuro rameico dimostrano la sua importanza in vari campi, rendendolo un composto prezioso nelle attività industriali e scientifiche.
Domande:
D: Qual è la massa molare del bromuro di rame(II)?
R: La massa molare del bromuro rameico(II) è circa 223,36 g/mol.
D: Qual è la formula del bromuro di rame(II)?
R: La formula del bromuro rameico(II) è CuBr2.
D: Il bromuro di rame(II) è solubile in acqua?
R: Il bromuro rameico(II) ha una solubilità limitata in acqua.
D: A cosa serve il bromuro di rame(II)?
R: Il bromuro di rame(II) viene utilizzato come catalizzatore nella sintesi organica, nella fotografia, nella galvanica e nell’industria dei semiconduttori.
D: Il bromuro di zinco e rame è una sostituzione una tantum?
R: Sì, il bromuro di zinco e rameico(II) subiscono un’unica reazione di sostituzione, producendo bromuro di zinco e Cu metallico.
D: Si verifica una reazione quando si combinano soluzioni acquose di acetato di bario e bromuro di rame (II)?
R: Sì, si verifica una reazione che porta alla formazione di bromuro di bario e acetato di rame(II).
D: Quali ioni, se presenti, si formano quando il bromuro di rame(II) viene aggiunto all’acqua?
R: Quando il bromuro rameico(II) viene aggiunto all’acqua, si dissocia in ioni Cu^2+ e ioni bromuro (Br^-).
D: CuBr2 forma un legame ionico?
R: Sì, CuBr2 forma un legame ionico tra gli ioni rame e bromo.
D: CuBr2 forma un legame covalente?
R: No, CuBr2 non forma un legame covalente.
D: CuBr2 è solubile in acqua?
R: CuBr2 ha una solubilità limitata in acqua.
D: Cos’è CuBr2?
R: CuBr2 è la formula chimica del bromuro rameico(II), un composto cristallino blu-verde.
D: CuBr2 è solubile o insolubile?
R: CuBr2 è scarsamente solubile in acqua.
D: Qual è la percentuale in massa di rame in CuBr2?
R: La percentuale in massa di rame in CuBr2 è di circa il 47,5%.
