Lo ioduro di rame (CuI) è un composto chimico di colore giallo brillante. Si forma quando il rame reagisce con lo iodio e viene utilizzato in varie applicazioni tra cui la sintesi organica e la catalisi.
| Nome IUPAC | Ioduro di rame(I). |
| Formula molecolare | CuI |
| numero CAS | 7681-65-4 |
| Sinonimi | Ioduro rameoso, monoioduro di rame, ioduro rameoso (1:1) |
| InChI | InChI=1S/Cu.HI/h;1H/q+1;/p-1 |
Proprietà dello ioduro di rame
Formula dello ioduro di rame
La formula chimica dello ioduro rameoso è CuI. Ciò indica che ciascuna unità di ioduro rameoso è costituita da un atomo di rame (Cu) e un atomo di iodio (I). Questa semplice formula rappresenta la stechiometria del composto.
Massa molare dello ioduro di rame
La massa molare dello ioduro rameoso (CuI) può essere calcolata sommando le masse atomiche dei suoi elementi costitutivi. Il rame ha una massa molare di circa 63,55 g/mol, mentre lo iodio ha una massa molare di circa 126,90 g/mol. Pertanto, la massa molare di CuI è di circa 190,45 g/mol.
Punto di ebollizione dello ioduro di rame
Lo ioduro rameoso non ha un punto di ebollizione ben definito poiché subisce una decomposizione prima di raggiungere il punto di ebollizione. Quando riscaldato, si decompone in rame metallico e iodio gassoso, rendendolo inadatto alla tradizionale determinazione del punto di ebollizione.
Punto di fusione dello ioduro di rame
Il punto di fusione dello ioduro rameoso è relativamente basso rispetto a molti altri alogenuri metallici. Il suo punto di fusione è di circa 606 gradi Celsius (1.123 gradi Fahrenheit). A questa temperatura, lo ioduro rameoso solido si trasforma in un liquido fuso.
Densità dello ioduro di rame g/mL
Lo ioduro rameoso ha una densità di circa 5,67 g/mL. Questo valore rappresenta la massa di ioduro rameoso per unità di volume. Ciò indica che lo ioduro rameoso è relativamente denso rispetto ad altri composti inorganici.
Peso molecolare dello ioduro di rame
Il peso molecolare dello ioduro rameoso, chiamato anche massa molare, è di circa 190,45 g/mol. È la somma dei pesi atomici di tutti gli atomi presenti in una molecola di ioduro rameoso (CuI).
Struttura dello ioduro di rame
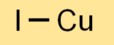
Lo ioduro rameoso esiste in varie strutture cristalline, comprese le fasi alfa, beta e gamma. La forma più comune è la fase alfa, che ha una struttura di miscela di zinco. Forma una rete di atomi di rame e iodio.
Solubilità dello ioduro di rame
La solubilità dello ioduro rameoso in diversi solventi varia. È scarsamente solubile in acqua e la sua solubilità può essere aumentata aggiungendo ioni ioduro. I solventi organici come l’etanolo possono dissolverlo più efficacemente dell’acqua.
| Aspetto | Solido giallo brillante |
| Peso specifico | 5,67 g/ml |
| Colore | GIALLO |
| Odore | Inodore |
| Massa molare | 190,45 g/mole |
| Densità | 5,67 g/cm³ |
| Punto di fusione | 606°C (1123°F) |
| Punto di ebollizione | Si rompe prima dell’ebollizione |
| Punto flash | Non applicabile |
| solubilità in acqua | Scarsamente solubile |
| Solubilità | Solubile in solventi organici come etanolo ed etere |
| Pressione del vapore | Non disponibile |
| Densità del vapore | Non disponibile |
| pKa | Non disponibile |
| pH | Non applicabile |
Si tenga presente che alcune proprietà, quali punto di infiammabilità, pressione di vapore, densità di vapore, pKa e pH, non sono applicabili o disponibili per lo ioduro rameoso a causa della sua natura e delle sue proprietà.
Sicurezza e pericoli dello ioduro di rame
Lo ioduro rameoso comporta alcuni rischi per la sicurezza che devono essere considerati durante la manipolazione. È fondamentale indossare adeguati dispositivi di protezione individuale (DPI) come guanti e occhiali per evitare il contatto con la pelle e gli occhi. Evitare l’inalazione di polvere o fumi poiché ciò potrebbe causare irritazione alle vie respiratorie. Lo ioduro rameoso è moderatamente tossico se ingerito e non deve essere consumato. Inoltre, è essenziale lavorare con lo ioduro rameoso in un’area ben ventilata per evitare l’accumulo di vapori. Il corretto stoccaggio in contenitori ermeticamente chiusi, lontano da sostanze incompatibili, è fondamentale per ridurre al minimo i potenziali rischi.
| Simboli di pericolo | Irritante |
| Descrizione della sicurezza | Provoca irritazione alla pelle e agli occhi. Moderatamente tossico se ingerito. Evitare l’inalazione. Utilizzare in un’area ben ventilata. Indossare DPI adeguati. |
| Numeri di identificazione delle Nazioni Unite | Non applicabile |
| Codice SA | Non applicabile |
| Classe di pericolo | Non applicabile |
| Gruppo di imballaggio | Non applicabile |
| Tossicità | Moderatamente tossico se ingerito |
Metodi per la sintesi dello ioduro di rame
Lo ioduro rameoso può essere sintetizzato con diversi metodi. Un metodo comune per sintetizzare lo ioduro rameoso prevede la miscelazione di Cu finemente polverizzato con iodio e il riscaldamento della miscela in un ambiente controllato. All’aumentare della temperatura, il Cu reagisce con lo iodio per formare ioduro rameoso.
Un altro approccio consiste nell’aggiungere ossido di rame (CuO) o idrossido di rame (Cu(OH)2) all’acido idriodico (HI) e riscaldare la miscela. La reazione tra l’acido e il composto di rame porta alla formazione di ioduro rameoso.
Lo ioduro rameoso può anche essere ottenuto mescolando un sale di Cu, come CuSO4 , con un sale ioduro solubile come lo ioduro di potassio (KI) in acqua. Questa reazione porta alla precipitazione dello ioduro rameoso.
Inoltre, una reazione di doppio spostamento tra un sale di Cu solubile come il solfato di rame e un sale ioduro solubile come lo ioduro di sodio (NaI) in una soluzione acquosa fornisce ioduro rameoso solido come precipitato. .
Questi metodi di sintesi offrono diversi percorsi per ottenere lo ioduro rameoso, consentendone l’utilizzo in un’ampia gamma di applicazioni in chimica e nell’industria.
Usi dello ioduro di rame
Lo ioduro rameoso trova applicazioni versatili in vari campi grazie alle sue proprietà uniche. Ecco alcuni dei suoi principali utilizzi:
- Sintesi organica: lo ioduro rameoso funge da catalizzatore nelle reazioni organiche, promuovendo varie reazioni di accoppiamento come le reazioni di Ullmann, Sonogashira e Glaser.
- Semiconduttori: viene utilizzato nella produzione di semiconduttori, in particolare come materiale semiconduttore di tipo P.
- Dispositivi fotovoltaici: lo ioduro rameoso viene utilizzato nelle celle solari e nei fotorilevatori grazie alle sue proprietà di fotoconduttività e assorbimento della luce.
- Galvanotecnica: viene utilizzato come additivo elettrolitico nei bagni galvanici per migliorare la deposizione del rame.
- Pigmenti: il colore giallo brillante dello ioduro rameoso lo rende prezioso come pigmento nell’industria della ceramica e del vetro.
- Vernice antivegetativa: È un componente essenziale delle vernici antivegetative per applicazioni marine.
- Reagenti chimici: lo ioduro rameoso viene utilizzato nei laboratori come reagente chimico per vari test ed esperimenti.
- Agenti di contrasto per raggi X: nell’imaging medico, gli agenti di contrasto allo ioduro rameoso vengono utilizzati per gli esami radiografici.
- Conservante del legno: lo ioduro rameoso protegge il legno dalla putrefazione e dalle infestazioni di insetti, rendendolo utile nell’industria del legname.
- Fungicidi: agisce come un efficace fungicida, proteggendo le colture e le piante dalle infezioni fungine.
Le numerose applicazioni dello ioduro rameoso dimostrano la sua importanza in molti settori, dall’elettronica e dal fotovoltaico all’agricoltura e alla medicina.
Domande:
D: Come produrre lo ioduro di rame?
R: Lo ioduro rameoso può essere sintetizzato facendo reagire il rame metallico o l’ossido di rame con iodio o mediante reazioni di doppio spostamento utilizzando solfato di rame e ioduro di potassio.
D: Lo ioduro rameoso è solubile in acqua?
R: No, lo ioduro rameoso (CuI2) è insolubile in acqua.
D: Qual è l’equazione molecolare per la reazione del nitrato di rame II e dello ioduro di potassio?
R: L’equazione molecolare è Cu(NO3)2 + 2KI → CuI2 + 2KNO3.
D: Qual è la formula dello ioduro rameoso?
R: La formula per lo ioduro rameoso è CuI2.
D: Lo ioduro di rame(II) è insolubile?
R: Sì, lo ioduro rameoso (II) (CuI2) è insolubile in acqua.
D: È sicuro mescolare solfato di rame e ioduro di potassio?
R: La miscelazione di CaSO4 e ioduro di potassio può produrre ioduro rameoso, ma è necessario prestare attenzione a causa della reattività delle sostanze chimiche coinvolte.
D: Qual è il nome del composto di formula CUI2?
R: Il composto con la formula CUI2 è lo ioduro rameoso (II).
D: CUI2 è un precipitato?
R: Sì, CUI2 può formare un precipitato in alcune reazioni a causa della sua bassa solubilità in acqua.
D: CUI2 è solubile in acqua?
R: No, CUI2 non è solubile in acqua.
D: CUI2 è solubile?
R: No, CUI2 non è solubile nella maggior parte dei solventi comuni.
D: Cosa rende CUI2 intrattabile?
R: La bassa solubilità di CUI2 è dovuta al suo forte legame ionico tra rame e iodio, che porta a una dissociazione limitata in acqua.
