L’acetato di rame (Cu(CH3COO)2) è un composto cristallino blu-verde. Si forma quando il rame reagisce con l’acido acetico. Trova applicazioni in vari settori, come catalizzatori e fungicidi.
| Nome IUPAC | Acetato di rame(II). |
| Formula molecolare | Cu(CH3COO)2 |
| numero CAS | 142-71-2 |
| Sinonimi | Acetato rameico, sale di rame dell’acido acetico, diacetato di rame |
| InChI | InChI=1S/2C2H4O2.Cu/c2 1-2(3)4;/h2 1H3,(H,3,4);/q;;+2/p-2 |
Proprietà dell’acetato di rame
Formula di acetato di rame
L’acetato rameico ha la formula chimica Cu(CH3COO)2. È costituito da un atomo di rame (Cu) legato a due gruppi acetato (CH3COO). La formula rappresenta il rapporto degli elementi nel composto.
Massa molare dell’acetato di rame
La massa molare dell’acetato rameico può essere calcolata sommando le masse atomiche dei suoi elementi costitutivi. Il rame (Cu) ha una massa molare di 63,55 g/mol, mentre l’acetato (CH3COO) ha una massa molare di 59,04 g/mol. Pertanto, la massa molare dell’acetato rameico è 181,63 g/mol.
Punto di ebollizione dell’acetato di rame
L’acetato rameico si decompone prima di raggiungere il punto di ebollizione a causa della sua instabilità termica. Il suo punto di ebollizione non è quindi ben definito. Invece, subisce una decomposizione se riscaldato in modo significativo.
Punto di fusione dell’acetato di rame
L’acetato rameico fonde tipicamente tra 115°C e 120°C (239°F e 248°F). Il punto di fusione può variare leggermente a seconda della purezza del composto.
Densità dell’acetato di rame g/mL
La densità dell’acetato rameico è di circa 1,882 g/mL. Questo valore corrisponde alla massa di acetato rameico per unità di volume. La densità può variare con i cambiamenti di temperatura e pressione.
Peso molecolare dell’acetato di rame
Il peso molecolare dell’acetato rameico, calcolato dalla sua formula, è 181,63 g/mol. Rappresenta la somma dei pesi atomici di tutti gli atomi presenti in una molecola di acetato rameico.
Struttura in acetato di rame
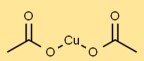
L’acetato rameico ha una struttura reticolare cristallina nella sua forma solida. Gli atomi di rame sono coordinati con i gruppi acetato, formando una disposizione stabile. Appare come cristalli blu-verdi a causa della sua geometria di coordinazione.
Solubilità dell’acetato di rame
L’acetato rameico ha una moderata solubilità in acqua. Può dissolversi in solventi polari a causa della presenza di ioni acetato. Tuttavia, la solubilità può essere limitata e la sua dissoluzione può essere influenzata dalla temperatura e dal pH.
| Aspetto | Solido cristallino blu-verde |
| Peso specifico | 1.882 g/ml |
| Colore | Blu verde |
| Odore | Inodore |
| Massa molare | 181,63 g/mole |
| Densità | 1.882 g/ml |
| Punto di fusione | 115°C – 120°C (239°F – 248°F) |
| Punto di ebollizione | Decomposto |
| Punto flash | Non applicabile |
| solubilità in acqua | Moderata solubilità in acqua |
| Solubilità | Solubile in solventi polari, poco solubile in etere e glicerolo |
| Pressione del vapore | Non disponibile |
| Densità del vapore | Non disponibile |
| pKa | Non disponibile |
| pH | Acido (circa 4-5) |
Sicurezza e pericoli dell’acetato di rame
L’acetato rameico pone alcuni problemi e pericoli per la sicurezza. È essenziale maneggiarlo con cura e seguire i protocolli di sicurezza. Il contatto diretto con il composto può causare irritazione alla pelle e agli occhi. L’inalazione della polvere o dei vapori può causare disturbi respiratori. Evitare l’ingestione poiché potrebbe essere dannoso. Tenerlo lontano da materiali incompatibili e fonti di calore o accensione per evitare il rischio di incendio. In caso di esposizione accidentale, sciacquare immediatamente le aree interessate e consultare un medico. Conservare l’acetato di rame in un’area ben ventilata e sicura, lontano dalla portata dei bambini e delle persone non autorizzate. Utilizzare sempre dispositivi di protezione individuale adeguati quando si lavora con questo composto.
| Simboli di pericolo | Corrosivo, tossico acuto, irritante |
| Descrizione della sicurezza | Evitare il contatto diretto con la pelle e gli occhi. Utilizzare in un’area ben ventilata. Maneggiare con cura. |
| Numeri di identificazione delle Nazioni Unite | Non attribuito |
| Codice SA | 29152900 |
| Classe di pericolo | 6.1 (Sostanze tossiche) |
| Gruppo di imballaggio | III (Basso pericolo) |
| Tossicità | Può causare irritazione alla pelle e agli occhi. L’inalazione può causare disturbi respiratori. Evitare di ingerire. |
Metodi per la sintesi dell’acetato di rame
Esistono diversi metodi per sintetizzare l’acetato rameico.
Un approccio comune prevede la reazione tra ossido di rame (CuO) o idrossido di rame (Cu(OH)2) con acido acetico (CH3COOH). Combinano e mescolano le due sostanze, il che porta alla formazione di acetato rameico e acqua. Un altro metodo è la reazione del carbonato di rame (CuCO3) con acido acetico, producendo acetato rameico, anidride carbonica (CO2) e acqua.
Un metodo di sintesi alternativo prevede la reazione del rame metallico con una miscela di acido acetico e perossido di idrogeno (H2O2). Questa reazione porta alla formazione di acetato rameico e acqua. L’acetato rameico risulta dalla reazione tra solfato di rame (II) (CuSO4) e acetato di calcio (Ca(CH3COO)2. Questa reazione produce acetato rameico e solfato di calcio (CaSO4).
Il riscaldamento e il riflusso di una miscela di polvere di rame e acido acetico glaciale produce acetato rameico. Questo processo porta alla formazione di acetato rameico. La disponibilità dei reagenti e la purezza desiderata del prodotto finale determinano i vantaggi distinti di ciascun metodo.
Usi dell’acetato di rame
L’acetato di rame trova applicazioni versatili in vari settori grazie alle sue proprietà uniche. Ecco alcuni usi importanti:
- Catalizzatore: l’acetato rameico catalizza molte reazioni organiche, inclusa la sintesi di acetato di vinile e anidride acetica.
- Galvanotecnica: l’acetato rameico aiuta i processi di galvanica, conferendo un sottile strato di rame agli oggetti metallici, migliorandone l’aspetto e la resistenza alla corrosione.
- Intermedi chimici: il composto svolge un ruolo cruciale come intermedio nella produzione di vari prodotti chimici come l’ossido di rame, il naftenato di rame e i saponi di rame.
- Conservante del legno: l’acetato di rame agisce come conservante del legno, proteggendo il legno da funghi e attacchi di insetti, comunemente usato per preservare traversine ferroviarie e pali della luce.
- Fungicida: in agricoltura, l’acetato di rame viene utilizzato come fungicida per controllare le malattie fungine nelle colture, soprattutto nei vigneti e nei frutteti.
- Pirotecnica: l’acetato di rame trova applicazione nelle formulazioni pirotecniche, producendo vivaci colori blu e verdi in fuochi d’artificio e razzi.
- Tintura dei tessuti: Agisce come mordente nei processi di tintura dei tessuti, facilitando il legame dei coloranti alle fibre.
- Reagente di laboratorio: il composto funge da reagente negli esperimenti di laboratorio per analisi qualitative e quantitative.
- Chimica analitica: l’acetato di rame viene utilizzato come reagente di prova in chimica analitica per rilevare il gas di idrogeno solforato.
- Repellente per animali: funziona come repellente per animali per scoraggiare alcuni parassiti e animali selvatici da aree specifiche.
Le diverse applicazioni dell’acetato rameico evidenziano la sua importanza in vari settori, dalla sintesi chimica all’agricoltura e oltre. Una manipolazione attenta e le seguenti precauzioni di sicurezza sono essenziali quando si utilizza questo composto in diversi processi.
Domande:
D: L’acetato di rame II è covalente?
R: No, l’acetato rameico II è un composto ionico.
D: Qual è il coefficiente di estinzione molare a 625 nm per questa soluzione di acetato di rame II?
R: Il coefficiente di estinzione molare a 625 nm per la soluzione di acetato rameico II è specifico della concentrazione della soluzione e deve essere determinato sperimentalmente.
D: Puoi mettere l’acetato rameico monoidrato in una fossa settica?
R: L’acetato di rame monoidrato non è consigliato per l’uso come fossa settica o detergente per scarichi a causa di potenziali pericoli e preoccupazioni ambientali.
D: Si verifica una reazione quando si combinano soluzioni acquose di acetato di bario e bromuro di rame (II)?
R: Sì, si verifica una reazione quando soluzioni acquose di acetato di bario e bromuro di rame (II) vengono combinate, dando luogo alla formazione di un precipitato (bromuro di bario) e di acetato di rame solubile.
D: Qual è il punto di fusione dell’acetato rameico?
R: Il punto di fusione dell’acetato rameico è compreso tra circa 115°C e 120°C (tra 239°F e 248°F).
D: Come produrre l’acetato rameico dal solfato di rame?
A: Per produrre acetato rameico da CuSO4, sciogliere CuSO4 in acqua, quindi aggiungere acido acetico alla soluzione fino a quando l’acetato rameico precipita. Filtrare ed asciugare il prodotto.
D: Cos’è l’acetato rameico?
R: L’acetato rameico è un composto chimico con la formula Cu(CH3COO)2. È un solido cristallino blu-verde e ha varie applicazioni industriali.
D: L’acetato rameico è solubile in acqua?
R: Sì, l’acetato rameico è moderatamente solubile in acqua, formando una soluzione blu-verde.
D: Perché la soluzione di acetato rameico è torbida?
R: La soluzione di acetato rameico può diventare torbida a causa della presenza di impurità o della formazione di composti di rame insolubili, soprattutto se la soluzione non è adeguatamente preparata o conservata.
D: Ossidazione di Cu(OAc)2?
R: L’acetato di rame(II) (Cu(OAc)2) può agire come agente ossidante in alcune reazioni, dove subisce una riduzione mentre ossida altre sostanze.
