L’idrossido di rame (Cu(OH)2) è un solido blu formato dalla reazione dei sali di rame con gli ioni idrossido. Viene utilizzato come fungicida e in vari processi chimici.
| Nome IUPAC | Idrossido di rame(II). |
| Formula molecolare | Cu(OH)2 |
| numero CAS | 20427-59-2 |
| Sinonimi | Idrossido di rame; Diidrossido di rame; CuOH2 |
| InChI | InChI=1S/Cu.2H2O/h;2*1H2/q+2;;/p-2 |
Proprietà dell’idrossido di rame
Formula dell’idrossido di rame
La formula chimica dell’idrossido rameico è Cu(OH)2. Rappresenta la combinazione di uno ione rame (Cu2+) e due ioni OH tenuti insieme da legami ionici. Questo composto solido blu è comunemente usato in vari settori grazie alle sue proprietà uniche.
Massa molare dell’idrossido di rame
La massa molare dell’idrossido rameico (Cu(OH)2) può essere calcolata sommando le masse atomiche dei suoi elementi costitutivi. Il rame (Cu) ha una massa atomica di circa 63,55 g/mol e ciascuno ione OH- ha una massa atomica combinata di circa 17,01 g/mol. La massa molare dell’idrossido rameico è quindi di circa 97,55 g/mol.
Punto di ebollizione dell’idrossido di rame
L’idrossido di rame non ha un punto di ebollizione distinto perché si decompone prima di raggiungere il punto di ebollizione. Quando riscaldato, subisce una reazione di decomposizione termica per formare ossido di rame e vapore acqueo.
Punto di fusione dell’idrossido di rame
L’idrossido di rame ha un punto di fusione di circa 200°C (392°F). A questa temperatura il solido subisce una transizione di fase e si trasforma in uno stato liquido.
Densità dell’idrossido di rame g/mL
La densità dell’idrossido rameico è di circa 3,36 g/mL. Questo valore rappresenta la massa di un millilitro di idrossido rameico, indicandone la compattezza e la concentrazione.
Peso molecolare dell’idrossido di rame
Il peso molecolare dell’idrossido rameico è di circa 97,55 g/mol. Si calcola sommando i pesi atomici di tutti gli atomi presenti in una molecola di idrossido rameico.
Struttura dell’idrossido di rame
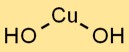
L’idrossido rameico adotta una struttura cristallina, con ioni Cu2+ circondati da ioni OH- in una disposizione planare trigonale. Questa disposizione del reticolo cristallino contribuisce alla sua stabilità e proprietà distintive.
Solubilità dell’idrossido di rame
L’idrossido rameico ha una solubilità limitata in acqua. Forma una sospensione scarsamente solubile in acqua, ovvero solo una piccola quantità del composto si dissolve nel solvente. La solubilità può essere influenzata da fattori quali temperatura e pH.
| Aspetto | Blu solido |
| Peso specifico | ~3,36 g/ml |
| Colore | Blu |
| Odore | Inodore |
| Massa molare | ~97,55 g/mole |
| Densità | ~3,36 g/ml |
| Punto di fusione | ~200°C (392°F) |
| Punto di ebollizione | Decomposto |
| Punto flash | N / A |
| solubilità in acqua | Scarsamente solubile |
| Solubilità | Limitato, varia con la temperatura e i livelli di pH |
| Pressione del vapore | N / A |
| Densità del vapore | N / A |
| pKa | N / A |
| pH | Alcalino (basico) |
Sicurezza e pericoli dell’idrossido di rame
L’idrossido di rame pone alcune considerazioni sulla sicurezza e sui rischi. È generalmente considerato a bassa tossicità, ma può causare irritazione alla pelle, agli occhi e alle vie respiratorie per contatto o inalazione. Quando si maneggia questo composto è necessario adottare misure protettive adeguate, come indossare guanti e occhiali di sicurezza. In caso di ingestione o esposizione accidentale, è necessaria l’immediata assistenza medica. Inoltre, l’idrossido di rame deve essere conservato in un’area sicura e ben ventilata, lontano da sostanze incompatibili. È necessario seguire procedure di smaltimento adeguate per evitare la contaminazione dell’ambiente. Seguire le precauzioni di sicurezza è fondamentale per ridurre al minimo i potenziali rischi associati all’idrossido di rame.
| Simboli di pericolo | Nessuno |
| Descrizione della sicurezza | Bassa tossicità; Irritante |
| Numeri di identificazione delle Nazioni Unite | Non applicabile |
| Codice SA | 2825.90.5000 |
| Classe di pericolo | Non classificato come pericoloso |
| Gruppo di imballaggio | Non classificato |
| Tossicità | Debole |
Metodi di sintesi dell’idrossido di rame
Esistono diversi metodi attivi per sintetizzare l’idrossido rameico.
Un approccio comune prevede la reazione di un sale di Cu, come CuSO4 , con una base forte come l’idrossido di sodio (NaOH) o l’idrossido di potassio (KOH) . Durante questo processo, gli ioni idrossido (OH-) della base spostano gli ioni solfato (SO4^2-) nel CuSO4 , formando idrossido rameico (Cu(OH)2) come precipitato blu.
Un altro metodo prevede la reazione di un sale di rame(II) con ammoniaca (NH3). Aggiungendo ammoniaca ad una soluzione di Cu(II), l’idrossido rameico precipita a causa della combinazione degli ioni Cu2+ con gli ioni idrossido dell’ammoniaca.
L’elettrolisi consente la sintesi dell’idrossido rameico immergendo un elettrodo di Cu in una soluzione elettrolitica e applicando una corrente elettrica continua. La riduzione dell’acqua al catodo genera ioni idrossido, portando alla formazione di idrossido rameico.
Questi metodi di sintesi attiva forniscono mezzi controllati ed efficienti per produrre idrossido rameico per varie applicazioni industriali e di ricerca.
Usi dell’idrossido di rame
L’idrossido di rame trova molteplici applicazioni in vari settori grazie alle sue proprietà uniche e alla sua natura versatile. Alcuni usi notevoli includono:
- Fungicida: gli agricoltori lo utilizzano ampiamente come fungicida protettivo per controllare le malattie fungine in colture come frutta, verdura e piante ornamentali.
- Intermedi chimici: funge da prezioso intermedio chimico nella sintesi di vari composti di rame, come l’ossido di rame e i sali di rame.
- Preservante del legno: tratta il legno e fornisce protezione contro gli insetti xilofagi e i funghi che causano marciume, prolungando così la vita delle strutture in legno.
- Agente antibatterico: in alcune formulazioni agisce come agente antibatterico, trovando applicazioni in ambito medico e sanitario.
- Trattamento acquatico: aiuta a gestire le alghe e le erbe infestanti acquatiche in stagni, laghi e altri corpi idrici, mantenendo l’equilibrio ecologico.
- Industria della ceramica e del vetro: i produttori lo utilizzano come colorante per conferire vivaci tonalità blu e verdi ai prodotti in ceramica e vetro.
- Pirotecnica: contribuisce alla colorazione di fuochi d’artificio e razzi, svolgendo un ruolo nelle applicazioni pirotecniche.
- Produzione di batterie: trova il suo utilizzo nella produzione di batterie come materiale per elettrodi, facilitando l’accumulo di energia.
- Vernici e rivestimenti: alcune formulazioni di vernici lo incorporano per conferire proprietà protettive e antimicrobiche.
La diversità delle applicazioni evidenzia l’importanza dell’idrossido di rame in molteplici settori, rendendolo un composto prezioso per vari usi pratici.
Domande:
D: L’idrossido di rame è solubile?
R: L’idrossido rameico ha una solubilità limitata in acqua, formando una sospensione scarsamente solubile.
D: Quante moli ci sono in 68 grammi di idrossido di rame(II) Cu(OH)2?
R: In 68 grammi ci sono circa 0,697 moli di Cu(OH)2.
D: L’idrossido di rame II è solubile in acqua?
R: L’idrossido rameico II ha una solubilità limitata in acqua.
D: L’idrossido di sodio e il solfato di rame sono una reazione chimica?
R: Sì, la reazione tra NaOH e CuSO4 porta alla formazione di idrossido rameico e solfato di sodio.
D: L’idrossido di rame(II) è solubile?
R: L’idrossido di rame(II) ha una solubilità limitata in acqua.
D: Qual è il colore dell’idrossido di rame?
R: L’idrossido rameico è di colore blu.
D: L’idrossido di rame è un alcalino?
R: L’idrossido di rame è una base ma non è classificato come alcali.
D: L’idrossido di rame è una base forte?
R: L’idrossido di rame non è considerato una base forte.
D: Il Cu(OH)2 è solubile in acqua?
R: Cu(OH)2 ha una solubilità limitata in acqua.
D: Quante moli ci sono in 68 grammi di idrossido di rame(II) Cu(OH)2?
R: In 68 grammi ci sono circa 0,697 moli di Cu(OH)2.
D: Quante moli ci sono in 34 grammi di Cu(OH)2?
R: In 34 grammi ci sono circa 0,3485 moli di Cu(OH)2.
D: Si forma un Cu(OH)2 solido quando 0,075 g di KOH vengono sciolti in 1,0 L di Cu(NO3)2 a 1,0 × 10^−3 M?
R: Sì, il Cu(OH)2 solido si forma come precipitato a causa della reazione tra KOH e Cu(NO3)2.
