Il nitrato di rame (Cu(NO3)2) è un composto cristallino blu utilizzato in vari settori. Serve come catalizzatore, agente ossidante e precursore per materiali di rame nei processi chimici.
| Nome IUPAC | Nitrato di rame(II). |
| Formula molecolare | Cu(NO3)2 |
| numero CAS | 3251-23-8 |
| Sinonimi | Nitrato rameico; Nitrato di rame; Nitrato di rame; Acido nitrico, sale di rame (2+) |
| InChI | InChI=1S/2NO3.Cu/c2 2-1(3)4;/q2 -1;+2 |
Proprietà del nitrato di rame
Formula di nitrato di rame
La formula chimica del nitrato rameico è Cu(NO3)2. Ciò indica che ciascuna molecola di nitrato rameico contiene uno ione rame (Cu) e due ioni nitrato (NO3). La presenza di ioni rame(II) denota uno stato di ossidazione +2 del rame.
Massa molare del nitrato di rame
La massa molare del nitrato rameico può essere calcolata sommando le masse atomiche dei suoi elementi costitutivi. Il rame (Cu) ha una massa molare di circa 63,55 g/mol, mentre il nitrato (NO3) ha una massa molare di circa 62,00 g/mol. Pertanto, la massa molare del nitrato rameico è di circa 187,55 g/mol.
Punto di ebollizione del nitrato di rame
Il punto di ebollizione del nitrato rameico si riferisce alla temperatura alla quale passa da liquido a gas sotto pressione atmosferica standard. Il punto di ebollizione del nitrato rameico è generalmente superiore a 100°C (212°F). Tuttavia, è importante notare che il nitrato rameico generalmente si decompone prima di raggiungere il punto di ebollizione.
Punto di fusione del nitrato di rame
Il punto di fusione del nitrato rameico è la temperatura alla quale passa dallo stato solido a quello liquido. Il punto di fusione del nitrato rameico è generalmente compreso tra 256°C e 260°C (493°F e 500°F). È essenziale maneggiare questa sostanza con cura per evitare la sua decomposizione.
Densità del nitrato di rame g/mL
La densità del nitrato rameico si riferisce alla sua massa per unità di volume. La densità del nitrato rameico solido è generalmente intorno a 2,32 g/mL, mentre la densità delle sue soluzioni acquose può variare a seconda della concentrazione.
Peso molecolare del nitrato di rame
Il peso molecolare del nitrato rameico è la somma dei pesi atomici di tutti gli atomi nella sua formula chimica. Per Cu(NO3)2, il peso molecolare è di circa 187,55 g/mol.
Struttura del nitrato di rame
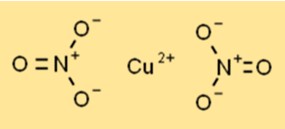
Il nitrato rameico esiste come un solido cristallino blu con una struttura cristallina esagonale. Ogni ione rame (Cu2+) è circondato da sei atomi di ossigeno provenienti da due ioni nitrato, creando una disposizione coordinata. La struttura contribuisce alla sua stabilità e reattività in vari processi chimici.
Solubilità del nitrato di rame
Il nitrato rameico è moderatamente solubile in acqua. Forma una soluzione acquosa quando disciolta in acqua, che può essere utilizzata in varie applicazioni come la galvanica e come reagente nelle reazioni chimiche. Tuttavia, la sua solubilità diminuisce con temperature più basse.
| Aspetto | Solido cristallino blu |
| Peso specifico | N / A |
| Colore | Blu |
| Odore | Inodore |
| Massa molare | 187,55 g/mole |
| Densità | 2,32 g/ml (solido) |
| Punto di fusione | 256-260°C (493-500°F) |
| Punto di ebollizione | Si rompe prima dell’ebollizione |
| Punto flash | N / A |
| solubilità in acqua | Moderatamente solubile, forma una soluzione acquosa |
| Solubilità | Solubile in acqua |
| Pressione del vapore | N / A |
| Densità del vapore | N / A |
| pKa | N / A |
| pH | Acido |
Sicurezza e pericoli del nitrato di rame
Il nitrato rameico pone alcuni problemi di sicurezza e di pericolo. È essenziale maneggiare questo composto con cautela. Il contatto diretto con la pelle o gli occhi può causare irritazioni o ustioni. L’inalazione di polvere o fumi può causare irritazione respiratoria. Se riscaldato, può rilasciare ossidi di azoto tossici. La sostanza è anche un agente ossidante e può incendiare materiali infiammabili al contatto. Quando si lavora con il nitrato di rame è necessario indossare dispositivi di protezione adeguati, come guanti e occhiali protettivi. Dovrebbe essere conservato lontano da materiali combustibili e sostanze incompatibili per ridurre al minimo i rischi potenziali. Seguire sempre le istruzioni di sicurezza e utilizzare in un’area ben ventilata.
| Simboli di pericolo | Agente ossidante, Corrosivo, Irritante |
| Descrizione della sicurezza | Maniglia con cauzione. Evitare il contatto con la pelle e gli occhi. Utilizzare in un’area ben ventilata. Tenere lontano da materiali combustibili. |
| Numeri di identificazione delle Nazioni Unite | UN3085 |
| Codice SA | 28342910 |
| Classe di pericolo | 5.1 (Agente ossidante) |
| Gruppo di imballaggio | III |
| Tossicità | Nocivo se ingerito. Può causare irritazione alla pelle e agli occhi. L’inalazione di polvere o fumi può causare irritazione respiratoria. |
Metodi di sintesi del nitrato di rame
Esistono diversi metodi per sintetizzare il nitrato rameico.
Un approccio comune prevede la reazione tra ossido di rame (CuO) o idrossido di rame (Cu(OH)2) con acido nitrico (HNO3) . Quando si prepara il nitrato rameico, si può aggiungere lentamente ossido rameico o idrossido rameico a una soluzione di acido nitrico, portando alla formazione di nitrato rameico e acqua.
Un altro metodo prevede la reazione tra rame metallico (Cu) e acido nitrico concentrato. Il metallo Cu reagisce con l’acido nitrico per produrre nitrato rameico, biossido di azoto (NO2) e acqua. Questo metodo richiede un’attenta manipolazione a causa della formazione di gas tossico di biossido di azoto.
In alternativa, è possibile sciogliere il rame metallico o l’ossido rameico in una miscela di acido nitrico e perossido di idrogeno (H2O2) per produrre nitrato rameico. Questo metodo consente una reazione più rapida e produce nitrato di rame puro.
Infine, la reazione di doppio spostamento tra CuSO4 e nitrato di sodio (NaNO3) può produrre anche nitrato rameico. Miscelando questi due sali in acqua, il nitrato rameico precipita e il sottoprodotto solfato di sodio rimane disciolto.
Seguire le precauzioni di sicurezza durante la sintesi poiché le sostanze chimiche coinvolte mostrano reattività. Utilizzare dispositivi di protezione adeguati e utilizzare pratiche di laboratorio adeguate per garantire una sintesi sicura e di successo del nitrato di rame.
Usi del nitrato di rame
Il nitrato di rame trova varie applicazioni in diversi settori grazie alle sue proprietà uniche. Alcuni usi notevoli includono:
- Catalizzatore: agisce come catalizzatore nella sintesi organica, facilitando reazioni come la conversione di alcoli in aldeidi o chetoni.
- Articoli pirotecnici: il nitrato di rame è un componente chiave delle formulazioni pirotecniche, poiché contribuisce ai colori blu e verdi delle fiamme.
- Agricoltura: in agricoltura, funge da fonte di rame nei fertilizzanti per fornire nutrienti essenziali alle piante.
- Agente ossidante: il nitrato di rame ossida attivamente altre sostanze durante i processi chimici.
- Placcatura dei metalli: il nitrato di rame deposita attivamente un sottile strato di Cu su varie superfici metalliche durante i processi di galvanica.
- Pigmenti e coloranti: il nitrato di rame contribuisce attivamente alla creazione di pigmenti verdi e blu per ceramica, vetro e tessuti.
- Processi fotografici: il nitrato di rame contribuisce attivamente allo sviluppo dell’immagine in alcune soluzioni fotografiche.
- Conservazione: Trova applicazione nella preservazione del legno aiutando a fissare i conservanti.
- Preparazione di altri composti di rame: serve come precursore per la sintesi di vari materiali e composti a base di rame.
La versatilità e la reattività del nitrato di rame lo rendono un prodotto chimico prezioso in una varietà di campi, dai processi industriali alle applicazioni artistiche.
Domande:
D: Cosa succede quando il nitrato di rame viene riscaldato?
R: Quando riscaldato, il nitrato rameico si decompone in ossido rameico, biossido di azoto e ossigeno.
D: Il nitrato di rame è solubile in acqua?
R: Sì, il nitrato rameico è moderatamente solubile in acqua.
D: Qual è la formula chimica del nitrato di rame?
R: La formula chimica del nitrato rameico è Cu(NO3)2.
D: Il nitrato di rame è un elettrolita forte?
R: Sì, il nitrato rameico è un potente elettrolita, che si dissocia in ioni quando disciolto in acqua.
D: Qual è la carica del nitrato di rame?
R: Il nitrato di rame ha una carica netta pari a 0; è un composto neutro.
D: Quanti atomi di azoto ci sono in 10,2 g di nitrato di rame(II)?
R: Ci sono circa 0,161 moli di nitrato rameico (II), e quindi circa 0,322 moli di atomi di azoto.
D: Quanto argento può essere prodotto da 3,00 moli di rame e 3,85 moli di nitrato d’argento?
R: Si possono produrre 342,3 g di argento, seguendo l’equazione chimica bilanciata.
D: Il nitrato di rame è solubile?
R: Sì, il nitrato rameico è solubile in acqua.
D: Qual è la formula del nitrato di rame (II)?
R: La formula del nitrato rameico(II) è Cu(NO3)2.
D: Cosa produce la reazione di sostituzione di Cu(NO3)2 e Zn?
R: Nella reazione di sostituzione vengono prodotti il nitrato di zinco (Zn(NO3)2) e il metallo rameico (Cu).
D: Cos’è Cu(NO3)2?
R: Cu(NO3)2 è la formula chimica del nitrato rameico, un composto cristallino blu.
D: Quale dei seguenti viene ridotto nella seguente reazione? Cu(NO3)2 + Zn -> Zn(NO3)2 + Cu
R: Il rame (Cu) viene ridotto durante la reazione, acquistando elettroni per formare rame metallico.
D: Si forma un Cu(OH)2 solido quando 0,075 g di KOH vengono sciolti in 1,0 L di Cu(NO3)2 1,0 × 10⁻³ M?
R: No, il Cu(OH)2 solido non si forma poiché Cu(NO3)2 si ionizza completamente in soluzione e c’è un eccesso di ioni OH⁻ da KOH.
