Il bicarbonato di litio (LiHCO3) è un composto chimico utilizzato in varie applicazioni. Ha proprietà alcaline e viene utilizzato nella ricerca, nei prodotti farmaceutici e come potenziale trattamento per determinate condizioni mediche.
| Nome IUPAC | Bicarbonato di litio |
| Formula molecolare | LiHCO3 |
| numero CAS | 5006-97-3 |
| Sinonimi | Carbonato acido di litio, bicarbonato di litio |
| InChI | InChI=1S/CH2O3.Li/c2-1(3)4;/h(H2,2,3,4);/q;+1 |
Proprietà del bicarbonato di litio
Formula di bicarbonato di litio
Il carbonato acido di litio ha la formula chimica LiHCO3. È costituito da un catione di litio (Li), un anione idrogeno carbonato (HCO3) e un atomo di idrogeno (H). La formula riflette la presenza di ioni litio e bicarbonato nel composto.
Massa molare del bicarbonato di litio
La massa molare del carbonato acido di litio (LiHCO3) è di circa 68 grammi per mole (g/mol). Si calcola sommando le masse atomiche dei suoi elementi costitutivi: litio, idrogeno, carbonio e ossigeno.
Punto di ebollizione del bicarbonato di litio
Il carbonato acido di litio non ha un punto di ebollizione ben definito perché si decompone ad alte temperature. Quando si riscalda perde anidride carbonica (CO2) e acqua (H2O), trasformandosi in carbonato di litio (Li2CO3).
Punto di fusione del bicarbonato di litio
Il carbonato acido di litio ha un punto di fusione di circa 250 gradi Celsius (482 gradi Fahrenheit). A questa temperatura subisce una transizione di fase dallo stato solido a quello liquido.
Densità del bicarbonato di litio g/mL
La densità del carbonato acido di litio (LiHCO3) è di circa 2,21 grammi per millilitro (g/mL). È un composto relativamente denso a causa della presenza di litio e altri elementi pesanti.
Peso molecolare del bicarbonato di litio
Il carbonato acido di litio ha un peso molecolare di circa 68 g/mol. Il peso molecolare rappresenta la somma dei pesi atomici di tutti gli atomi presenti in una singola molecola del composto.
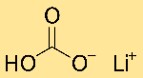
Struttura del bicarbonato di litio
Il carbonato acido di litio ha una struttura cristallina. Forma una rete di atomi di litio, carbonato di idrogeno e idrogeno, disposti secondo uno schema ripetuto. La struttura è tenuta insieme da legami ionici e covalenti.
Solubilità del bicarbonato di litio
Il carbonato acido di litio è scarsamente solubile in acqua. Si dissolve in una certa misura in acqua, dando una soluzione leggermente alcalina. Tuttavia, la sua solubilità è relativamente bassa rispetto ad altri composti del litio.
| Aspetto | Polvere cristallina bianca |
| Peso specifico | ~2,21 g/ml |
| Colore | Bianco |
| Odore | Inodore |
| Massa molare | ~68 g/mole |
| Densità | ~2,21 g/ml |
| Punto di fusione | ~250°C (482°F) |
| Punto di ebollizione | Decomposto |
| Punto flash | Non applicabile |
| solubilità in acqua | Leggermente solubile, dà una soluzione leggermente alcalina |
| Solubilità | Limite |
| Pressione del vapore | Non disponibile |
| Densità del vapore | Non disponibile |
| pKa | Non disponibile |
| pH | Leggermente alcalino |
Sicurezza e pericoli del bicarbonato di litio
Il carbonato acido di litio presenta alcune considerazioni e pericoli sulla sicurezza. È essenziale maneggiare attentamente il composto per ridurre al minimo i rischi. Il contatto diretto con la pelle o gli occhi può causare irritazione. Evitare l’inalazione di polvere o fumi poiché ciò potrebbe causare disturbi respiratori. Quando riscaldato si decompone rilasciando anidride carbonica e vapore acqueo, che possono essere potenzialmente pericolosi negli spazi chiusi. Inoltre, è fondamentale conservare correttamente il carbonato acido di litio, lontano da sostanze incompatibili. Quando si lavora con questo composto è necessario utilizzare una ventilazione adeguata e dispositivi di protezione individuale per garantire un ambiente sicuro.
| Simboli di pericolo | Non disponibile |
| Descrizione della sicurezza | Maneggiare con cura. Evitare l’inalazione, il contatto con la pelle e gli occhi. Conservare correttamente. Utilizzare in aree ben ventilate. |
| Numeri di identificazione delle Nazioni Unite | Non disponibile |
| Codice SA | Non disponibile |
| Classe di pericolo | Non disponibile |
| Gruppo di imballaggio | Non disponibile |
| Tossicità | Bassa tossicità; gestire con cauzione. |
Metodi per sintetizzare il bicarbonato di litio
Vari metodi consentono la sintesi del carbonato acido di litio.
Un approccio comune consiste nel far reagire l’idrossido di litio (LiOH) con l’anidride carbonica (CO2). La reazione avviene in una soluzione acquosa dove l’idrossido di litio si dissocia in ioni litio e idrossido. Allo stesso tempo, l’anidride carbonica si dissolve in acqua, formando acido carbonico (H2CO3) . Gli ioni di litio reagiscono quindi con l’acido carbonico per produrre idrogenocarbonato di litio (LiHCO3) e acqua (H2O). L’equazione chimica per questa reazione è:
LiOH + CO2 → LiHCO3 + H2O
Un altro metodo prevede il trattamento del carbonato di litio (Li2CO3) con anidride carbonica in un sistema chiuso, producendo bicarbonato di litio. L’equazione chimica per questa reazione è:
Li2CO3 + CO2 → 2LiHCO3
Questi metodi di sintesi sono importanti per la produzione di carbonato acido di litio in laboratorio e per applicazioni industriali. È fondamentale seguire i protocolli di sicurezza e garantire attrezzature e condizioni adeguate durante il processo di sintesi.
Usi del bicarbonato di litio
Il carbonato acido di litio trova molte applicazioni grazie alle sue proprietà uniche. Ecco alcuni dei suoi principali utilizzi:
- Ricerca e laboratorio: funge da prezioso reagente in vari esperimenti chimici e di ricerca, consentendo agli scienziati di studiare reazioni e proprietà chimiche.
- Potenziale trattamento medico: sono in corso studi sul suo potenziale ruolo come trattamento per malattie come la carenza di litio e alcuni disturbi renali, nonché come agente alcalinizzante.
- Applicazioni ambientali: può contribuire alla rimozione dell’anidride carbonica dai processi industriali e ha potenziali applicazioni nella mitigazione delle emissioni di gas serra.
- Agente alcalinizzante: in specifici processi industriali, agisce come agente alcalinizzante per controllare l’acidità e regolare i livelli di pH.
- Industria farmaceutica: le formulazioni farmaceutiche utilizzano il carbonato acido di litio principalmente nei farmaci per i disturbi dell’umore come il disturbo bipolare.
- Produzione di batterie al litio: ricercatori e circoli sperimentali stanno esplorando l’uso del carbonato acido di litio nelle batterie avanzate a base di litio per migliorare le prestazioni della batteria.
- Trattamento dell’acqua: i processi di trattamento dell’acqua utilizzano bicarbonato di litio per regolare il pH delle fonti d’acqua.
- Agricoltura: il carbonato acido di litio trova un uso limitato nelle pratiche agricole, dove gli agricoltori lo utilizzano per trattare condizioni specifiche del terreno e migliorare la crescita delle piante.
Nonostante queste applicazioni, è fondamentale maneggiare con cura il carbonato acido di litio e seguire le precauzioni di sicurezza, dati i suoi potenziali pericoli e reattività. Man mano che la ricerca e i progressi tecnologici continuano, potrebbero emergere nuovi usi per il carbonato acido di litio, aumentandone ulteriormente l’importanza in vari campi.
Domande:
D: Qual è la formula chimica del bicarbonato di litio?
R: La formula chimica del carbonato acido di litio è LiHCO3.
D: Il bicarbonato di litio può causare bassi livelli di vitamina D?
R: Non ci sono prove che suggeriscano che il carbonato acido di litio causi bassi livelli di vitamina D.
D: Cosa funziona meglio: carbonato di litio o bicarbonato di litio?
R: L’efficacia del carbonato di litio o del bicarbonato di litio dipende dalle loro applicazioni specifiche e dall’uso previsto.
D: Il bicarbonato di litio interagisce con l’estratto di valeriana?
R: Non sono note interazioni tra il carbonato acido di litio e l’estratto di valeriana, ma è essenziale consultare un operatore sanitario.
D: Cos’è il bicarbonato di litio?
R: Il carbonato acido di litio è un composto chimico con proprietà alcaline, utilizzato in una varietà di applicazioni tra cui la ricerca e i prodotti farmaceutici.
D: Il bicarbonato di litio e il carbonato di litio possono essere riscaldati in acqua?
R: Il carbonato acido di litio e il carbonato di litio possono essere riscaldati in acqua, ma si decompongono per formare altri composti.
D: Qual è la perdita di peso quando vengono scomposti 3,45 g di LiHCO3?
R: La perdita di peso quando vengono decomposti 3,45 g di LiHCO3 dipenderà dalla reazione specifica e dai prodotti formati.
D: LiHCO3 è un elettrolita forte?
R: No, il carbonato acido di litio (LiHCO3) è un elettrolita debole.
D: Quale sale verrebbe prodotto dalla reazione di H2SO4 con LiHCO3?
R: La reazione tra H2SO4 e LiHCO3 produrrà solfato di litio (Li2SO4), anidride carbonica (CO2) e acqua (H2O).
D: LiHCO3 è un acido o una base?
R: Il carbonato acido di litio (LiHCO3) funge da base grazie alle sue proprietà alcaline.
D: La N-metiletanamina reagisce con LiHCO3?
R: La reattività della N-metiletanamina con LiHCO3 dipenderà dalle condizioni di reazione specifiche e dai prodotti desiderati.
