L’ossido di litio (Li2O) è un composto costituito da litio e ossigeno. Presenta forti proprietà ioniche ed è ampiamente utilizzato nelle batterie grazie al suo elevato potenziale elettrochimico.
| Nome IUPAC | Ossido di litio |
| Formula molecolare | Li2O |
| numero CAS | 12142-77-7 |
| Sinonimi | Ossido di litio(I); Ossido di dilitio; Lizia; ossalitio; UNII-06T3K8P3KU |
| InChI | InChI=1S/2Li.O |
Formula di ossido di litio
Formula di ossido di litio
La formula chimica dell’ossido di dilitio è Li2O. Rappresenta la combinazione di due atomi di litio (Li) e un atomo di ossigeno (O). Questo composto semplice e stabile è essenziale in varie applicazioni industriali.
Massa molare dell’ossido di litio
La massa molare di Li2O è di circa 29,88 g/mol. Si calcola sommando le masse atomiche di due atomi di litio (6,94 g/mol ciascuno) e un atomo di ossigeno (16,00 g/mol).
Punto di ebollizione dell’ossido di litio
L’ossido di dilitio ha un punto di ebollizione impressionante di circa 2.463 gradi Celsius (4.465 gradi Fahrenheit). Questo punto di ebollizione eccezionalmente elevato lo rende utile nelle industrie che richiedono un’estrema resistenza al calore.
Punto di fusione dell’ossido di litio
Il punto di fusione dell’ossido di dilitio è di circa 1.450 gradi Celsius (2.642 gradi Fahrenheit). Quando esposto a questa temperatura, passa dallo stato solido a quello liquido, facilitando vari processi produttivi.
Densità dell’ossido di litio g/mL
L’ossido di dilitio ha una densità di circa 2,01 g/mL. Questo valore rappresenta la massa del composto per unità di volume ed è essenziale per determinarne le proprietà e le applicazioni.
Peso molecolare dell’ossido di litio
Il peso molecolare di Li2O è 29,88 g/mol. È la somma dei pesi atomici dei suoi elementi costitutivi, litio e ossigeno. Questo valore facilita i calcoli stechiometrici.
Struttura dell’ossido di litio
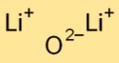
L’ossido di dilitio ha una struttura cristallina ionica semplice. È costituito da cationi di litio (Li+) e anioni di ossido (O2-) tenuti insieme da forti forze elettrostatiche. Questa disposizione contribuisce alla sua stabilità e conduttività.
Solubilità dell’ossido di litio
L’ossido di dilitio ha una bassa solubilità in acqua. Reagisce con l’acqua per formare idrossido di litio, limitandone la dissoluzione. Tuttavia, presenta una certa solubilità in alcuni solventi non acquosi e sali fusi.
In conclusione, l’ossido di dilitio è un composto importante con varie caratteristiche e applicazioni. La sua struttura stabile, gli elevati punti di fusione e di ebollizione lo rendono prezioso in settori quali la ceramica, la produzione del vetro e come componente di batterie specializzate. Comprenderne le proprietà ci permette di sfruttarne le potenzialità per vari scopi.
| Aspetto | Solido bianco |
| Peso specifico | 2,01 g/ml |
| Colore | Bianco |
| Odore | Inodore |
| Massa molare | 29,88 g/mole |
| Densità | 2,01 g/ml |
| Punto di fusione | 1.450°C (2.642°F) |
| Punto di ebollizione | 2463°C (4465°F) |
| Punto flash | Non applicabile |
| solubilità in acqua | Reagisce con l’acqua |
| Solubilità | Scarsa solubilità in acqua, sotto forma di idrossido di litio |
| Pressione del vapore | Non disponibile |
| Densità del vapore | Non disponibile |
| pKa | Non applicabile |
| pH | Non applicabile |
Si prega di notare che alcune proprietà come punto di infiammabilità, pressione di vapore, densità di vapore, pKa e pH non sono applicabili o disponibili per Li2O a causa della sua natura chimica e del suo comportamento.
Sicurezza e pericoli dell’ossido di litio
L’ossido di dilitio pone alcuni problemi e pericoli in termini di sicurezza. Reagisce fortemente con l’acqua producendo idrossido di litio, che è caustico e può causare irritazioni alla pelle e agli occhi. L’inalazione delle sue polveri o dei suoi fumi può causare irritazione respiratoria. Il composto non è classificato come altamente tossico ma deve essere maneggiato con cura per evitare il contatto con la pelle o gli occhi. Una ventilazione adeguata e dispositivi di protezione individuale sono essenziali quando si lavora con l’ossido di dilitio. In caso di ingestione accidentale è necessario l’immediato intervento medico. Inoltre, deve essere conservato lontano da sostanze incompatibili per evitare qualsiasi rischio potenziale di incendio o esplosione.
| Simboli di pericolo | Corrosivo |
| Descrizione della sicurezza | Reagisce con l’acqua. Provoca irritazione alla pelle e agli occhi. Maneggiare con cura. Evitare l’inalazione di polvere o fumi. |
| Numeri di identificazione delle Nazioni Unite | Non applicabile |
| Codice SA | 2825.70.00 |
| Classe di pericolo | 8 (Sostanze corrosive) |
| Gruppo di imballaggio | III |
| Tossicità | Non molto tossico, ma è necessaria cautela. Evitare l’ingestione e il contatto con la pelle o gli occhi. |
Metodi di sintesi dell’ossido di litio
Vari metodi consentono la sintesi dell’ossido di dilitio.
Un approccio comune prevede la reazione del litio metallico con ossigeno o aria ad alte temperature. In questo processo, l’ossigeno facilita il riscaldamento del litio metallico, con conseguente formazione di ossido di dilitio.
Un altro metodo è la decomposizione termica dei sali di litio, come il carbonato di litio o l’idrossido di litio , a temperature elevate. Sottoponendo questi sali al calore, si decompongono per produrre ossido di dilitio.
Inoltre, per produrre ossido di dilitio, è possibile utilizzare l’idrossido di litio come precursore. Viene prima disidratato mediante riscaldamento, trasformandolo nella forma di ossido desiderata.
Un’altra tecnica prevede l’uso di minerali o minerali contenenti litio. I processi chimici estraggono composti di litio da queste fonti naturali, che, a loro volta, vengono sottoposti a ulteriore lavorazione per produrre ossido di dilitio.
È essenziale notare che ciascun metodo di sintesi può presentare vantaggi e sfide specifici in termini di costo, efficienza e purezza. Scienziati e ingegneri considerano questi fattori quando scelgono il metodo più appropriato per produrre ossido di dilitio per soddisfare specifici requisiti industriali o di ricerca.
Usi dell’ossido di litio
L’ossido di dilitio (Li2O) trova applicazioni versatili in vari settori grazie alle sue proprietà uniche. Ecco alcuni usi chiave:
- Industria ceramica: l’ossido di dilitio è un componente cruciale della ceramica, poiché ne migliora la resistenza meccanica e la stabilità termica. Riduce inoltre la temperatura di cottura, risparmiando energia durante il processo di produzione.
- Produzione del vetro: nell’industria del vetro, l’ossido di dilitio agisce come un flusso, abbassando la temperatura di fusione del vetro e migliorandone la resistenza agli attacchi chimici, ottenendo prodotti in vetro di alta qualità.
- Tecnologia delle batterie: l’ossido di dilitio funge da precursore nella produzione di batterie agli ioni di litio. Contribuisce ai materiali catodici della batteria, migliorandone così la capacità di accumulo di energia e le prestazioni complessive.
- Essiccante: la forte affinità dell’ossido di dilitio per l’acqua lo rende un essiccante efficace, utilizzato per rimuovere l’umidità da determinati ambienti, come nei sistemi di condizionamento dell’aria e di purificazione del gas.
- Metallurgia: nei processi metallurgici, l’ossido di dilitio aiuta nella raffinazione dei metalli rimuovendo le impurità.
- Vetri speciali: la produzione di vetri speciali per varie applicazioni, come ottica, elettronica e strumenti scientifici, prevede l’uso di ossido di dilitio.
- Catalizzatore: l’ossido di dilitio funge da catalizzatore in alcune reazioni chimiche, facilitando la trasformazione dei reagenti nei prodotti desiderati.
- Industria nucleare: nell’industria nucleare, l’ossido di dilitio funziona come moderatore di neutroni, controllando la velocità delle reazioni di fissione nucleare.
La diversità delle applicazioni evidenzia l’importanza dell’ossido di dilitio nel progresso della tecnologia, della produzione e della ricerca scientifica. Le sue proprietà uniche continuano a guidare l’innovazione in vari settori, rendendolo un composto prezioso con un’ampia gamma di usi pratici.
Domande:
D: Quale equazione mostra che l’ossido di litio si forma dalla reazione tra ossigeno e litio?
R: 4Li + O2 → 2Li2O
D: Qual è la massa molare dell’ossido di litio, Li2O?
R: La massa molare di Li2O è di circa 29,88 g/mol.
D: Qual è la formula dell’ossido di litio?
R: La formula per l’ossido di dilitio è Li2O.
D: L’ossido di litio è ionico o covalente?
R: L’ossido di dilitio è ionico.
D: Qual è il numero di ossidazione del litio in un legame ionico?
R: Il numero di ossidazione del litio in un legame ionico è +1.
D: Numero di coordinazione del litio in Li2O?
R: Il numero di coordinazione del litio in Li2O è 4.
D: Il Li2O è ionico o covalente?
R: Li2O è ionico.
D: Quale delle seguenti reazioni è associata all’energia reticolare del Li2O (ΔH°latt)?
A: La reazione: Li+(g) + O2-(g) → Li2O(s)
D: Qual è la massa molare dell’ossido di litio, Li2O?
R: La massa molare di Li2O è di circa 29,88 g/mol.
D: Quale dei seguenti elementi verrà prodotto durante la combustione del litio metallico (Li)? O2, LiO, H2O, Li2O?
R: Li2O verrà prodotto durante la combustione del litio metallico (Li).
D: Quanti grammi ci sono in 4,5 moli di Li2O?
R: Ci sono circa 134,46 grammi in 4,5 moli di Li2O.
