Il cloruro d’oro (AuCl3) è un composto formato combinando l’oro con il cloro. Viene utilizzato in una varietà di applicazioni tra cui la placcatura in oro e come catalizzatore nelle reazioni chimiche.
| Nome IUPAC | Cloruro d’oro (III). |
| Formula molecolare | AuCl3 |
| numero CAS | 13453-07-1 |
| Sinonimi | Cloruro aurico, Triclorooro, Tricloruro d’oro |
| InChI | InChI=1S/3ClH.Au/h3*1H;/q;;;+3/p-3 |
Proprietà del cloruro d’oro
Formula di cloruro d’oro
La formula del tricloruro d’oro è AuCl3. È un composto chimico composto da un atomo di oro (Au) e tre atomi di cloro (Cl). Questa formula rappresenta la stechiometria degli elementi presenti nel tricloruro d’oro.
Massa molare del cloruro d’oro
La massa molare del tricloruro d’oro si calcola sommando le masse atomiche dei suoi elementi costitutivi. Per il tricloruro d’oro (AuCl3), la massa molare è di circa 303,33 g/mol. È utile per determinare la quantità di sostanza in un dato campione.
Punto di ebollizione del cloruro d’oro
Il tricloruro d’oro ha un punto di ebollizione di circa 254°C (gradi Celsius). A questa temperatura il composto passa dallo stato liquido a quello gassoso. Il punto di ebollizione indica la temperatura alla quale la pressione di vapore del liquido eguaglia la pressione atmosferica.
Punto di fusione del cloruro d’oro
Il punto di fusione del tricloruro d’oro è di circa 254°C (gradi Celsius). Questa è la temperatura alla quale la forma solida del composto si trasforma in liquida. Comprendere il punto di fusione è essenziale in vari processi industriali.
Densità del cloruro d’oro g/mL
La densità del tricloruro d’oro è di circa 4,7 g/ml (grammi per millilitro). La densità è la misura della massa per unità di volume di una sostanza. La densità relativamente elevata del tricloruro d’oro lo rende più pesante dell’acqua.
Peso molecolare del cloruro d’oro
Il peso molecolare del tricloruro d’oro, noto anche come massa molare, è di circa 303,33 g/mol (grammi per mole). È la somma dei pesi atomici di tutti gli atomi presenti nel composto. Il peso molecolare è cruciale nei calcoli chimici.
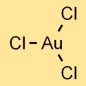
Struttura del cloruro d’oro
Il tricloruro d’oro (AuCl3) ha una struttura molecolare costituita da un atomo di oro legato a tre atomi di cloro. La disposizione forma una forma planare trigonale, con l’atomo di oro al centro e gli atomi di cloro che lo circondano.
Solubilità del cloruro d’oro
Il tricloruro d’oro ha una solubilità limitata in acqua. Si dissolve meglio in alcuni solventi organici, come etanolo e cloroformio. La solubilità del tricloruro d’oro è influenzata da fattori quali la temperatura e la natura del solvente.
| Aspetto | Solido giallo |
| Peso specifico | ~4,7 g/ml |
| Colore | GIALLO |
| Odore | Inodore |
| Massa molare | ~303,33 g/mole |
| Densità | ~4,7 g/ml |
| Punto di fusione | ~254°C |
| Punto di ebollizione | ~254°C |
| Punto flash | Non applicabile |
| solubilità in acqua | Solubilità limitata |
| Solubilità | Solubile in alcuni solventi organici come etanolo e cloroformio |
| Pressione del vapore | Non disponibile |
| Densità del vapore | Non disponibile |
| pKa | Non disponibile |
| pH | Neutro (pH 7) |
Sicurezza e pericoli del cloruro d’oro
Il tricloruro d’oro presenta potenziali rischi per la sicurezza e richiede un’attenta manipolazione. È fondamentale indossare dispositivi di protezione adeguati, come guanti e occhiali di sicurezza, per evitare il contatto con la pelle e l’irritazione degli occhi. L’inalazione delle sue polveri o vapori dovrebbe essere evitata a causa di potenziali problemi respiratori. Inoltre, l’esposizione a temperature elevate può provocare il rilascio di gas di cloro tossico. Il composto è inoltre incompatibile con forti agenti riducenti, che possono portare a reazioni pericolose. Per prevenire incidenti sono necessarie misure adeguate di stoccaggio, etichettatura e contenimento. Comprendere questi pericoli e le precauzioni di sicurezza è fondamentale quando si lavora con il tricloruro d’oro in laboratorio o in ambienti industriali.
| Simboli di pericolo | Rischio |
| Descrizione della sicurezza | Maneggiare con cura. Evitare il contatto con la pelle e gli occhi. Non inalare polveri o vapori. Tenere lontano da agenti riducenti forti. |
| Numeri di identificazione delle Nazioni Unite | Non disponibile |
| Codice SA | 2843.29 |
| Classe di pericolo | 6.1 (Sostanze tossiche) |
| Gruppo di imballaggio | II |
| Tossicità | Molto tossico se ingerito o inalato. Può causare irritazione alla pelle e agli occhi. |
Metodi per la sintesi del cloruro d’oro
Diversi metodi consentono la sintesi del tricloruro d’oro.
Un approccio comune consiste nel sciogliere l’oro o l’ossido di oro in acido cloridrico (HCl) . La reazione produce tricloruro d’oro e acqua. Un altro metodo prevede la reazione dell’oro con il cloro gassoso, formando direttamente il tricloruro d’oro. In alternativa, il cloro gassoso può reagire con l’oro metallico in presenza di un catalizzatore come il cloruro di ferro, producendo tricloruro d’oro e cloruro di ferro come sottoprodotti.
Un’altra via di sintesi prevede la reazione dell’oro metallico con acqua regia, una miscela di acido nitrico concentrato (HNO3) e acido cloridrico . Le potenti proprietà ossidanti dell’acqua regia convertono l’oro in tricloruro d’oro, che può essere isolato mediante evaporazione. Il tricloruro d’oro si forma quando l’acido cloridrico reagisce con l’ossido d’oro (III) (Au2O3), producendo tricloruro d’oro e acqua.
Vari agenti riducenti, come il cloruro di stagno (II) (SnCl2) o l’anidride solforosa (SO2), possono ridurre attivamente il cloruro d’oro (V) (AuCl5) per sintetizzare il tricloruro d’oro. La reazione produce tricloruro d’oro e il cloruro del corrispondente agente riducente.
Ciascun metodo presenta vantaggi e applicabilità, a seconda delle materie prime disponibili e della purezza desiderata del tricloruro d’oro. Un’attenta considerazione delle condizioni di reazione e delle misure di sicurezza è fondamentale durante il processo di sintesi.
Usi del cloruro d’oro
Il tricloruro d’oro trova varie applicazioni grazie alle sue proprietà uniche:
- Placcatura in oro: il tricloruro d’oro funge da fonte di ioni d’oro per i processi di galvanica, consentendo il deposito di un sottile strato d’oro sulle superfici. Ciò migliora la conduttività e fornisce una finitura attraente e resistente alla corrosione.
- Catalizzatore: il tricloruro d’oro agisce come catalizzatore in varie reazioni chimiche, in particolare nella sintesi organica. La sua capacità di attivare determinate connessioni lo rende prezioso per promuovere reazioni specifiche.
- Medicina: i ricercatori hanno esplorato i composti del tricloruro d’oro per potenziali applicazioni terapeutiche nel trattamento dell’artrite e di altre malattie infiammatorie.
- Fotografia: in fotografia, il tricloruro d’oro viene utilizzato come toner, conferendo i colori viola e marrone alle stampe in bianco e nero.
- Vetro e ceramica: l’industria del vetro utilizza il tricloruro d’oro per produrre il vetro rubino, conferendogli un colore rosso, e la ceramica trae vantaggio dal suo utilizzo per migliorare la colorazione.
- Nanotecnologia: il tricloruro d’oro svolge un ruolo cruciale nella nanotecnologia facilitando la sintesi di nanoparticelle d’oro, che hanno applicazioni nell’elettronica, nella catalisi e nell’imaging medico.
- Agente antibatterico: le nanoparticelle di tricloruro d’oro si sono dimostrate promettenti come agenti antibatterici, inibendo efficacemente la crescita di alcuni batteri.
- Conservazione dell’arte: nel restauro artistico, gli esperti utilizzano il tricloruro d’oro per dorare e ricreare i pigmenti storici.
- Reagente di laboratorio: gli scienziati lo usano come reagente di laboratorio per varie analisi chimiche e scopi di ricerca.
- Inchiostri metallici: i produttori utilizzano inchiostri al tricloruro d’oro per scopi di stampa, infondendo un tocco di lusso a prodotti come cancelleria e imballaggi.
Grazie alla sua versatilità e alle proprietà uniche, il tricloruro d’oro continua ad essere rilevante in vari settori, svolgendo un ruolo importante nella tecnologia, nell’arte, nella medicina e nella scienza dei materiali.
Domande:
D: Quale sostanza chimica posso usare per far precipitare l’oro dal cloruro d’oro?
R: Il metabisolfito di sodio (Na2S2O5) può essere utilizzato come agente riducente per far precipitare l’oro dalle soluzioni di tricloruro d’oro.
D: L’oro monoatomico è contenuto nel cloruro d’oro?
R: No, l’oro monoatomico non è tricloruro d’oro; è una forma distinta di oro composta da singoli atomi, non in uno stato composto.
D: Qual è la massa molare del cloruro d’oro III?
R: La massa molare del tricloruro d’oro III (AuCl3) è di circa 303,33 g/mol.
D: Cos’è il cloruro d’oro?
R: Il tricloruro d’oro (AuCl3) è un composto chimico formato combinando l’oro con il cloro, utilizzato in varie applicazioni come la doratura e la catalisi.
D: Come produrre il cloruro stannoso per testare l’oro?
R: Il cloruro stannoso (SnCl2) può essere preparato sciogliendo lo stagno metallico in acido cloridrico (HCl), seguito da riduzione.
D: Qual è la massa molare di AuCl3?
R: La massa molare di AuCl3 (tricloruro di oro III) è di circa 303,33 g/mol.
D: Qual è la percentuale di oro in AuCl3?
R: La percentuale di oro in AuCl3 è di circa il 42,49%.
D: Quante moli di H2O ci sono in 3,4 g di AuCl3 · 2 H2O?
R: Ci sono 0,0349 moli di H2O in 3,4 g di AuCl3 · 2 H2O.
D: AuCl3 è solubile in acqua?
R: Sì, AuCl3 (tricloruro di oro III) è in una certa misura solubile in acqua.
D: Quanti grammi di oro possono essere recuperati da 35 g di AuCl3?
R: Da 35 g di AuCl3 si possono recuperare circa 14,87 grammi di oro.
D: Qual è la solubilità molare di AuCl3? Ksp = 3,2 × 10−25
R: La solubilità molare di AuCl3, dato Ksp = 3,2 × 10−25, è circa 1,8 × 10^-9 mol/L.
