Il cloruro di piombo (PbCl2) è un solido cristallino bianco formato combinando piombo e cloro. Viene utilizzato in varie applicazioni, inclusi pigmenti, coloranti e come materia prima nella sintesi chimica.
| Nome IUPAC | Cloruro di piombo(II). |
| Formula molecolare | PbCl2 |
| numero CAS | 7758-95-4 |
| Sinonimi | Cloruro di piombo, cloruro di piombo, dicloruro di piombo (II), dicloruro di piombo |
| InChI | InChI=1S/2ClH.Pb/h2*1H;/q;;+2/p-2 |
Proprietà del cloruro di piombo
Formula del cloruro di piombo
La formula del dicloruro di piombo è PbCl2. Ciò indica che ciascuna unità di dicloruro di piombo contiene un atomo di piombo (Pb) e due atomi di cloro (Cl). Questo composto cristallino bianco è formato dalla combinazione di atomi di piombo e cloro.
Massa molare del cloruro di piombo
La massa molare del dicloruro di piombo è di circa 278,1 g/mol. Questo valore si ottiene sommando le masse atomiche di un atomo di piombo (207,2 g/mol) e due atomi di cloro (2 * 35,5 g/mol).
Punto di ebollizione del cloruro di piombo
Il dicloruro di piombo ha un punto di ebollizione di circa 1.074 gradi Celsius (1.967 gradi Fahrenheit). A questa temperatura, il dicloruro di piombo solido si trasforma allo stato gassoso.
Punto di fusione del cloruro di piombo
Il punto di fusione del dicloruro di piombo è di circa 501 gradi Celsius (934 gradi Fahrenheit). A questa temperatura, il dicloruro di piombo solido passa allo stato liquido.
Densità del cloruro di piombo g/mL
Il dicloruro di piombo ha una densità di circa 5,85 g/mL. Questo valore di densità indica la massa di dicloruro di piombo che occupa un millilitro di volume.
Peso molecolare del cloruro di piombo
Il peso molecolare del dicloruro di piombo è di circa 278,1 g/mol. Rappresenta la massa di una mole di molecole di dicloruro di piombo.
Struttura del cloruro di piombo
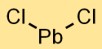
Il bicloruro di piombo ha una struttura cristallina in cui gli ioni piombo (Pb2+) sono circondati da ioni cloruro (Cl-) in una disposizione reticolare. Questo legame ionico contribuisce alla sua stabilità e proprietà.
Solubilità del cloruro di piombo
Il dicloruro di piombo ha una solubilità limitata in acqua. Si dissolve in acqua per formare una soluzione incolore e la sua solubilità può essere influenzata da fattori quali la temperatura e la presenza di altri ioni. Tuttavia, il dicloruro di piombo è più solubile in alcuni acidi, come l’acido cloridrico.
In sintesi, il dicloruro di piombo (PbCl2) è un composto cristallino bianco con una massa molare di circa 278,1 g/mol. Il suo punto di fusione è di circa 501 gradi Celsius e il suo punto di ebollizione è di circa 1.074 gradi Celsius. Con una densità di 5,85 g/ml, il dicloruro di piombo ha una solubilità limitata in acqua e forma una struttura cristallina distinta grazie al suo legame ionico tra gli ioni piombo e cloruro.
| Aspetto | Solido bianco |
| Peso specifico | 5,85 g/ml |
| Colore | Bianco |
| Odore | Inodore |
| Massa molare | 278,1 g/mole |
| Densità | 5,85 g/ml |
| Punto di fusione | 501°C |
| Punto di ebollizione | 1074°C |
| Punto flash | Non applicabile |
| solubilità in acqua | Limite |
| Solubilità | Solubile in alcuni acidi, come l’acido cloridrico |
| Pressione del vapore | Non disponibile |
| Densità del vapore | Non disponibile |
| pKa | Non disponibile |
| pH | Non disponibile |
Si prega di notare che alcune proprietà, come il punto di infiammabilità, la pressione del vapore, la densità del vapore, il pKa e il pH, non sono applicabili o non sono facilmente disponibili per il dicloruro di piombo.
Sicurezza e pericoli del cloruro di piombo
Il bicloruro di piombo pone diversi rischi per la sicurezza. È tossico se ingerito, inalato o assorbito attraverso la pelle, causando rischi per la salute, soprattutto per i bambini e le donne incinte. La manipolazione del bicloruro di piombo richiede dispositivi di protezione adeguati, come guanti e occhiali di sicurezza, per evitare il contatto con la pelle e gli occhi. Inoltre, dovrebbe essere utilizzato in aree ben ventilate per evitare l’inalazione di vapori tossici. Un’accurata conservazione e manipolazione sono essenziali per evitare fuoriuscite e contaminazioni. In caso di esposizione accidentale è necessaria l’immediata assistenza medica. A causa della sua tossicità, seguire le precauzioni di sicurezza e smaltire correttamente il dicloruro di piombo è essenziale per proteggere sia la salute umana che l’ambiente.
| Simboli di pericolo | Pericolo, tossico |
| Descrizione della sicurezza | Tossico; Nocivo se ingerito, inalato o assorbito attraverso la pelle. Usare con cautela. |
| Numeri di identificazione delle Nazioni Unite | N/A (il dicloruro di piombo non riceve un numero ONU) |
| Codice SA | 2827399000 |
| Classe di pericolo | 6.1 (Sostanze tossiche) |
| Gruppo di imballaggio | III (Gruppo di imballaggio III – Materie che presentano un pericolo minore) |
| Tossicità | Molto tossico; comporta rischi per la salute, soprattutto per i bambini e le donne incinte. Utilizzare misure di sicurezza adeguate. |
Si prega di notare che al dicloruro di piombo non viene assegnato un numero ONU specifico poiché non viene trasportato in grandi quantità, ma rientra nella classe di pericolo delle sostanze tossiche (6.1). È necessario adottare adeguate precauzioni di sicurezza durante la manipolazione e l’utilizzo del dicloruro di piombo a causa della sua tossicità.
Metodi per la sintesi del cloruro di piombo
Esistono vari metodi per sintetizzare il dicloruro di piombo. Un approccio comune consiste nel riscaldare il piombo metallico e far passare il cloro gassoso attraverso di esso, con conseguente formazione di dicloruro di piombo. Un altro metodo prevede la reazione dell’ossido di piombo (PbO) con l’acido cloridrico (HCl) per produrre dicloruro di piombo e acqua.
Un altro percorso include il metodo di precipitazione, in cui i sali di piombo solubili reagiscono con sali di cloruro solubili come il cloruro di sodio (NaCl) , producendo dicloruro di piombo come precipitato solido. Nelle reazioni a doppio spostamento, il dicloruro di piombo si forma quando il nitrato di piombo (Pb(NO3)2) reagisce con un sale cloruro solubile come il cloruro di sodio . La reazione produce bicloruro di piombo e nitrato di sodio (NaNO3).
Per garantire la sicurezza delle persone coinvolte e ridurre al minimo l’impatto sull’ambiente, è essenziale seguire adeguate precauzioni di sicurezza durante il processo di sintesi. Ciò include l’uso di una ventilazione adeguata e l’uso di dispositivi di protezione adeguati a causa della tossicità del dicloruro di piombo.
Usi del cloruro di piombo
Il bicloruro di piombo ha diversi usi in diversi settori. Ecco alcune delle sue applicazioni:
- Pigmenti: il dicloruro di piombo conferisce luminosità e opacità, rendendolo un pigmento bianco utilizzato in vernici, rivestimenti e coloranti.
- Sintesi chimica: svolge un ruolo cruciale come materia prima nei processi di sintesi chimica, in particolare nella produzione di altri composti di piombo e prodotti chimici.
- Stabilizzatore in PVC: il dicloruro di piombo migliora la stabilità termica e le prestazioni complessive del cloruro di polivinile (PVC) come stabilizzante durante la produzione.
- Reagente di laboratorio: i laboratori utilizzano il dicloruro di piombo come reagente attivo per test e analisi chimiche specifiche.
- Mordente nella tintura: funziona attivamente come mordente nei processi di tintura, facilitando l’attaccamento dei coloranti a tessuti e tessuti.
- Applicazioni nucleari: il dicloruro di piombo protegge efficacemente le radiazioni nei reattori e negli impianti nucleari grazie alla sua elevata densità e capacità di assorbire i raggi gamma.
- Galvanotecnica: nelle applicazioni galvaniche, il bicloruro di piombo deposita attivamente un sottile strato di piombo su varie superfici metalliche, migliorando la resistenza alla corrosione e la conduttività.
- Batterie: il dicloruro di piombo svolge un ruolo cruciale in alcuni tipi di batterie al piombo-acido, contribuendo alla chimica della batteria.
Sebbene il dicloruro di piombo abbia varie applicazioni, la sua natura tossica richiede un’attenta manipolazione e uno smaltimento adeguato per prevenire rischi per la salute e l’ambiente.
Domande:
D: Quante moli di PbCl2 si formeranno?
R: Il numero di moli formate dipende dalla quantità data di reagenti e dall’equazione chimica bilanciata.
D: PbCl2 è solubile in acqua?
R: PbCl2 ha una solubilità limitata in acqua.
D: Quante moli di PbCl2?
R: Il numero di moli di PbCl2 può essere determinato utilizzando la sua massa e la massa molare.
D: Quale dei seguenti è insolubile in acqua? Li2CO3, NaOH, PbCl2, Ba(OH)2, (NH4)2S.
R: PbCl2 è insolubile in acqua.
D: PbCl2 è un precipitato?
R: Sì, se gli ioni Pb2+ e Cl si combinano in una reazione per formare un solido, si tratta di un precipitato.
D: Quante moli di cloruro di piombo si formeranno?
R: Il numero di moli formate dipende dalla stechiometria della reazione.
D: Il cloruro di piombo è solubile in acqua?
R: Il bicloruro di piombo ha una solubilità limitata in acqua.
D: Quante unità di formula ci sono in 500,0 g di cloruro di piombo(II)?
R: Il numero di unità della formula può essere calcolato utilizzando la massa molare e la costante di Avogadro.
D: Come reagisce il cloruro di piombo(II) nell’acqua calda?
R: Il dicloruro di piombo(II) può dissolversi parzialmente in acqua calda a causa della sua maggiore solubilità con la temperatura.
D: Quanti grammi ci sono in 8,32 moli di cloruro di piombo(II)?
R: La massa può essere determinata utilizzando la massa molare del dicloruro di piombo(II) e il numero di moli indicato.
D: Il cloruro di piombo è solubile?
R: Il bicloruro di piombo ha una solubilità limitata in acqua.
D: Quale dei seguenti sposterebbe questa reazione al cloruro di piombo solido?
R: La rimozione degli ioni Cl- dalla miscela di reazione la sposterebbe verso la formazione di dicloruro di piombo solido.
D: Qual è la formula del dicloruro di piombo (IV)?
R: La formula del dicloruro di piombo (IV) è PbCl4.
D: La solubilità del dicloruro di piombo(II) (PbCl2) è 1,6 × 10^-2 M. Qual è il Ksp di PbCl2?
R: La Ksp (costante del prodotto di solubilità) per PbCl2 può essere calcolata dalla sua solubilità.
