Il cloruro mercurico è un composto tossico con la formula HgCl2. È un solido cristallino bianco utilizzato nei laboratori come reagente e disinfettante, ma è essenziale una corretta manipolazione.
| Nome IUPAC | Cloruro di mercurio (II). |
| Formula molecolare | HgCl2 |
| numero CAS | 7487-94-7 |
| Sinonimi | Dicloruro di mercurio, dicloruro di mercurio, bicloruro di mercurio, dicloruro di mercurio (II) |
| InChI | InChI=1S/2ClH.Hg/h2*1H;/q;;+2/p-2 |
Proprietà del cloruro mercurico
Formula del cloruro mercurico
La formula del dicloruro mercurico è HgCl2. È costituito da un atomo di mercurio (Hg) e due atomi di cloro (Cl). Questo composto è noto anche come cloruro di mercurio (II), che simboleggia lo stato di ossidazione +2 del mercurio.
Massa molare del cloruro mercurico
La massa molare del dicloruro di mercurio è di circa 271,52 g/mol. Si calcola sommando le masse atomiche di un atomo di mercurio (200,59 g/mol) e due atomi di cloro (35,45 g/mol ciascuno).
Punto di ebollizione del cloruro mercurico
Il dicloruro di mercurio ha un punto di ebollizione di circa 302°C (575,6°F). A questa temperatura, il dicloruro di mercurio solido si trasforma in vapore.
Punto di fusione del cloruro di mercurio
Il punto di fusione del dicloruro di mercurio è di circa -71°C (-95,8°F). A questa temperatura, il dicloruro di mercurio solido si trasforma in liquido.
Densità del cloruro mercurico g/mL
La densità del dicloruro di mercurio è di circa 5,4 g/mL. Questa alta densità la rende una sostanza relativamente pesante.
Peso molecolare del cloruro mercurico
Il peso molecolare del dicloruro di mercurio è di circa 271,52 g/mol. Indica la massa di una mole del composto e corrisponde alla somma dei suoi pesi atomici.
Struttura del cloruro di mercurio
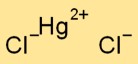
Il dicloruro mercurico ha una struttura cristallina. È costituito da ioni di mercurio con carica positiva (Hg2+) e ioni di cloruro con carica negativa (Cl-), tenuti insieme da legami ionici. La disposizione forma uno schema simile a un reticolo.
Solubilità del cloruro mercurico
Il dicloruro mercurico ha una solubilità limitata in acqua. Circa 7,7 grammi di dicloruro di mercurio si possono sciogliere in 100 ml di acqua a temperatura ambiente (20°C). La sua solubilità aumenta con temperature più elevate.
Il dicloruro di mercurio è una sostanza altamente tossica e deve essere maneggiata con estrema cautela. È stato ampiamente utilizzato in varie applicazioni, tra cui come reagente nei laboratori chimici, come disinfettante e nei processi di galvanica. A causa della sua tossicità, è essenziale seguire protocolli di sicurezza adeguati quando si lavora con questo composto.
| Aspetto | Solido cristallino bianco |
| Peso specifico | 5,4 g/ml |
| Colore | Bianco |
| Odore | Inodore |
| Massa molare | 271,52 g/mole |
| Densità | 5,4 g/ml |
| Punto di fusione | -71°C (-95,8°F) |
| Punto di ebollizione | 302°C (575,6°F) |
| Punto flash | Non applicabile |
| solubilità in acqua | Limite |
| Solubilità | Solubile in solventi organici come alcool, etere |
| Pressione del vapore | Trascurabile |
| Densità del vapore | 8.23 (aria = 1) |
| pKa | Non applicabile |
| pH | Acido (in acqua) |
Sicurezza e pericoli del cloruro di mercurio
Il dicloruro di mercurio presenta notevoli rischi per la sicurezza a causa della sua estrema tossicità. Il contatto diretto con la pelle o l’inalazione dei suoi vapori può provocare gravi problemi di salute. È fondamentale maneggiarlo con la massima cura, utilizzando adeguati dispositivi di protezione come guanti e respiratore. Lavorare sempre in un’area ben ventilata per ridurre al minimo l’esposizione. Conservarlo in contenitori ermeticamente chiusi, lontano da sostanze incompatibili. In caso di ingestione o esposizione accidentale consultare immediatamente un medico. È necessario seguire metodi di smaltimento adeguati per evitare la contaminazione dell’ambiente. Nel complesso, il rispetto rigoroso dei protocolli di sicurezza è fondamentale quando si ha a che fare con il dicloruro di mercurio.
| Simboli di pericolo | Teschio e ossa incrociate, corrosivo |
| Descrizione della sicurezza | Molto tossico e corrosivo. Utilizzare con estrema cautela. Evitare il contatto diretto e l’inalazione dei fumi. |
| Numeri di identificazione delle Nazioni Unite | UN1624 (Composti del mercurio, nas) |
| Codice SA | 2852.10.10 |
| Classe di pericolo | 6.1 (Sostanze tossiche) |
| Gruppo di imballaggio | II (Intermedio) |
| Tossicità | Estremamente tossico per l’uomo e gli animali. Maneggiare con cura e seguire rigorosi protocolli di sicurezza. |
Metodi per la sintesi del cloruro mercurico
Esistono diversi metodi per sintetizzare il dicloruro di mercurio.
Un approccio comune prevede la reazione del mercurio metallico con acido cloridrico . In un ambiente controllato, aggiungere mercurio all’acido per produrre dicloruro di mercurio e rilasciare gas idrogeno. L’equazione chimica per questa reazione è:
Hg + 2HCl -> HgCl2 + H2
Un altro metodo utilizza la reazione tra ossido di mercurio (HgO) e acido cloridrico . Combina l’ossido di mercurio con l’acido per formare dicloruro di mercurio e acqua:
HgO + 2HCl -> HgCl2 + H2O
Inoltre, il dicloruro di mercurio può essere prodotto facendo reagire il mercurio con il cloro gassoso:
Hg + Cl2 -> HgCl2
Ricordarsi di eseguire la sintesi del dicloruro mercurico solo sotto una cappa ben ventilata o in condizioni controllate a causa della sua natura tossica e corrosiva. Un’attenta manipolazione e le seguenti precauzioni di sicurezza sono essenziali per evitare un’esposizione dannosa durante il processo di sintesi.
Usi del cloruro di mercurio
Il dicloruro mercurico, noto anche come cloruro di mercurio (II), ha trovato varie applicazioni in diversi campi grazie alle sue proprietà uniche. Ecco alcuni dei suoi principali utilizzi:
Reagente di laboratorio: il dicloruro di mercurio funge da importante reagente nei laboratori chimici per varie procedure analitiche e sintetiche.
Disinfettante: le sue forti proprietà antimicrobiche lo rendono prezioso come disinfettante, in particolare per la sterilizzazione di attrezzature e superfici.
Medicina: anche se limitato a causa della sua tossicità, è stato utilizzato nella medicina tradizionale per determinate condizioni.
Fotografia: in passato, il cloruro di mercurio svolgeva un ruolo nella prima fotografia come agente fissante per lo sviluppo delle fotografie.
Galvanotecnica: nei processi di galvanica, gli individui utilizzano il dicloruro di mercurio come elettrolita per depositare rivestimenti metallici su vari oggetti.
Conservazione del legno: nel corso della storia, le persone lo hanno utilizzato per trattare il legno, proteggendolo dalla putrefazione e dai parassiti.
Industria tessile: i produttori utilizzavano il cloruro di mercurio per rimuovere il colore dai tessuti durante i processi di tintura.
Chimica analitica: i chimici lo utilizzano per test e reazioni specifici nell’analisi chimica.
Sintesi organica di nicchia: trova applicazioni in specifiche reazioni di sintesi organica.
Fungicida e alghicida: gli agricoltori lo utilizzano attivamente come fungicida e alghicida per controllare la crescita di funghi e alghe in agricoltura.
Domande:
D: HgCl2 è solubile o insolubile in acqua?
R: HgCl2 è leggermente solubile in acqua.
D: Quali sono il catione e l’anione del composto HgCl2?
R: Il catione è Hg2+ (mercurio) e l’anione è Cl- (cloruro).
D: HgCl2 è ionico o covalente?
R: HgCl2 è un composto ionico.
D: Come produrre il cloruro di mercurio in Minecraft?
R: In Minecraft, il dicloruro di mercurio può essere sintetizzato combinando mercurio e cloro in un tavolo di lavorazione.
D: A cosa serve il cloruro di mercurio?
R: Il dicloruro di mercurio viene utilizzato nei laboratori come reagente e disinfettante.
D: Chi ha inventato il cloruro di mercurio?
R: La scoperta e i primi utilizzi del dicloruro di mercurio risalgono a tempi antichissimi, quindi non esiste un inventario specifico.
D: Come realizzare il cloruro di mercurio in Minecraft Education Edition?
R: In Minecraft Education Edition, il dicloruro di mercurio può essere creato combinando mercurio e cloro in un tavolo da lavoro, proprio come nella versione standard di Minecraft.
D: Cos’è il cloruro di mercurio?
R: Il dicloruro di mercurio è un composto tossico con la formula chimica HgCl2.
D: HgCl2 è un solido?
R: Sì, HgCl2 è un solido a temperatura ambiente.
D: Qual è il nome corretto per HgCl2 nella denominazione ionica?
R: Il nome corretto per HgCl2 nella denominazione ionica è dicloruro di mercurio (II).
D: Qual è il nome di HgCl2?
R: Il nome di HgCl2 è dicloruro di mercurio.
D: 2 HgCl2(aq) + C2O4^(2-)(aq) → 2 Cl^-(aq) + 2 CO2(g) + Hg2Cl2(s), qual è la legge sulla velocità della reazione?
A: Legge sulla velocità: Velocità = k[HgCl2]^2[C2O4^2-] (secondo ordine rispetto a HgCl2 e primo ordine rispetto a C2O4^2-).
