L’ossido di boro (B2O3) è un composto formato dal legame chimico di boro e ossigeno. Viene utilizzato nella produzione di vetro e ceramica grazie al suo alto punto di fusione.
| Nome IUPAC | Ossido di boro |
| Formula molecolare | B2O3 |
| numero CAS | 1303-86-2 |
| Sinonimi | Triossido di triboro, ossido borico, ossido di boro (III). |
| InChI | InChI=1S/B2O3/c3-1-5-2(4)6-1 |
Proprietà dell’ossido di boro
Formula dell’ossido di boro
La formula chimica dell’ossido borico è B2O3. Rappresenta il rapporto tra gli atomi di boro e gli atomi di ossigeno nel composto. I numeri indice indicano che in ciascuna molecola di ossido borico sono presenti due atomi di boro e tre atomi di ossigeno.
Massa molare dell’ossido di boro
La massa molare dell’ossido borico può essere calcolata sommando le masse atomiche dei suoi elementi costitutivi. Il boro ha una massa atomica di 10,81 g/mol, mentre l’ossigeno ha una massa atomica di 16,00 g/mol. Moltiplicando le masse atomiche per il rispettivo numero di atomi e aggiungendole, si determina che la massa molare dell’ossido borico è 69,62 g/mol.
Punto di ebollizione dell’ossido di boro
L’ossido borico ha un punto di ebollizione elevato di circa 1.860 gradi Celsius. Ciò significa che alla normale pressione atmosferica è necessaria una notevole energia per convertire l’ossido borico dallo stato liquido allo stato gassoso.
Punto di fusione dell’ossido di boro
Il punto di fusione dell’ossido borico è di circa 450 gradi Celsius. A questa temperatura, l’ossido borico solido passa allo stato liquido. Il suo punto di fusione relativamente basso lo rende adatto a varie applicazioni industriali.
Densità dell’ossido di boro g/mL
L’ossido borico ha una densità di circa 2,46 g/mL. La densità si riferisce alla massa per unità di volume di una sostanza. La densità dell’ossido borico indica che è relativamente denso, permettendogli di fluire nella maggior parte dei liquidi.
Peso molecolare dell’ossido di boro
Il peso molecolare dell’ossido borico, chiamato anche massa molare, è 69,62 g/mol. Questo valore rappresenta la massa di una mole del composto ed è utile per calcolare la quantità di ossido borico in un dato campione.
Struttura dell’ossido di boro
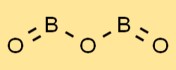
L’ossido borico ha una struttura unica, caratterizzata da una serie di unità BO3 planari trigonali. Gli atomi di boro sono circondati da tre atomi di ossigeno disposti triangolarmente. Questa disposizione conferisce all’ossido borico le sue proprietà caratteristiche e stabilità.
Solubilità dell’ossido di boro
L’ossido borico è insolubile in acqua e nella maggior parte dei solventi organici. La sua solubilità è limitata in acidi come acido solforico e acido cloridrico. Questa bassa solubilità contribuisce alla sua stabilità e utilità in varie applicazioni, come la produzione di vetro e ceramica.
| Aspetto | Solido bianco |
| Peso specifico | 2,46 g/ml |
| Colore | Bianco |
| Odore | Inodore |
| Massa molare | 69,62 g/mole |
| Densità | 2,46 g/ml |
| Punto di fusione | 450°C |
| Punto di ebollizione | 1860°C |
| Punto flash | Non applicabile |
| solubilità in acqua | Insolubile |
| Solubilità | Solubilità limitata negli acidi, come acido solforico e acido cloridrico |
| Pressione del vapore | Non applicabile |
| Densità del vapore | Non applicabile |
| pKa | Non applicabile |
| pH | Non applicabile |
Si prega di notare che alcune proprietà come punto di infiammabilità, pressione di vapore, densità di vapore, pKa e pH non sono applicabili o non sono state riportate per l’ossido borico.
Sicurezza e pericoli dell’ossido di boro
L’ossido borico pone alcune considerazioni sulla sicurezza e sui rischi. Il contatto diretto con polvere o polvere di ossido borico può irritare la pelle, gli occhi e il sistema respiratorio. È importante maneggiarlo con cura e utilizzare adeguati dispositivi di protezione individuale come guanti e occhiali. L’inalazione di particelle di ossido borico può causare irritazione alle vie respiratorie, quindi è consigliabile lavorare in ambienti ben ventilati. In caso di ingestione accidentale, consultare immediatamente un medico. L’ossido borico non è infiammabile e non ha punto di infiammabilità. Come per qualsiasi sostanza chimica, si raccomanda di seguire le linee guida corrette per la manipolazione e la conservazione per garantire un utilizzo sicuro.
| Simboli di pericolo | Non classificato |
| Descrizione della sicurezza | Evitare il contatto con la pelle e gli occhi. Utilizzare in un’area ben ventilata. Indossare dispositivi di protezione. |
| Numeri di identificazione delle Nazioni Unite | Non applicabile |
| Codice SA | 2810.00.2000 |
| Classe di pericolo | Non classificato |
| Gruppo di imballaggio | Non applicabile |
| Tossicità | Tossicità da bassa a moderata. Può causare irritazione per contatto o inalazione. |
Si prega di notare che l’ossido borico non riporta simboli di pericolo, identificazione ONU, classe di pericolo o gruppo di imballaggio. È importante seguire le linee guida e le pratiche generali di sicurezza durante la manipolazione e l’utilizzo dell’ossido borico per ridurre al minimo il rischio di esposizione e garantire un utilizzo sicuro.
Metodi per la sintesi dell’ossido di boro
Vari metodi consentono la sintesi dell’ossido borico. Un approccio ampiamente utilizzato consiste nel riscaldare il boro elementare in presenza di ossigeno o aria per creare ossido borico. Un altro metodo prevede la reazione degli alogenuri di boro, come il tricloruro di boro (BCl3) o il tribromuro di boro (BBr3), con acqua, con conseguente formazione di ossido borico.
Inoltre, i composti contenenti boro come il nitruro di boro o il trisolfuro di boro possono subire idrolisi con acqua per produrre ossido borico. La decomposizione termica dei borati, come il borato di sodio o il borace , se sottoposta al calore produce anche ossido borico.
È importante notare che la scelta di un metodo di sintesi specifico dipende dalla purezza, dalla quantità e dall’applicazione desiderate dell’ossido borico. Ciascun metodo presenta vantaggi e può essere adatto a situazioni diverse.
Usi dell’ossido di boro
L’ossido borico trova varie applicazioni in vari settori. Ecco alcuni dei suoi usi:
- Produzione di vetro e ceramica: l’ossido borico è un ingrediente chiave nella produzione di vetro e ceramica. Conferisce ai prodotti in vetro proprietà desiderabili come resistenza al calore, trasparenza e durata.
- Ritardanti di fiamma: i produttori utilizzano l’ossido borico come ritardante di fiamma in materiali come tessuti, plastica e prodotti in legno. L’ossido borico riduce l’infiammabilità di questi materiali, garantendo una maggiore sicurezza.
- Vetro borosilicato: l’ossido borico svolge un ruolo vitale come componente del vetro borosilicato, noto per la sua bassa dilatazione termica e l’elevata resistenza al calore. Le industrie utilizzano questo tipo di vetro nelle apparecchiature di laboratorio, negli utensili da cucina e nei dispositivi ottici di fascia alta.
- Fibre speciali: la produzione di fibre speciali, comprese le fibre di boro e le fibre di nitruro di boro, incorpora l’uso di ossido borico. Queste fibre possiedono proprietà meccaniche e termiche eccezionali, che le rendono adatte all’industria aerospaziale, automobilistica e high-tech.
- Prodotti chimici al boro: l’ossido borico funge da precursore per la sintesi di vari prodotti chimici al boro, come borati e idruri di boro. Queste sostanze chimiche trovano applicazioni nell’agricoltura, nei prodotti farmaceutici e nei sistemi di stoccaggio dell’energia.
- Flussi e agenti di saldatura: l’ossido borico riduce il punto di fusione dei materiali e ne migliora la fluidità, rendendolo un flusso efficace nei processi metallurgici. Migliora il legame delle superfici metalliche se utilizzato come agente saldante.
- Catalizzatori: le reazioni chimiche traggono vantaggio dai catalizzatori all’ossido borico perché promuovono reazioni desiderabili e aumentano la velocità di reazione.
- Industria dei semiconduttori: l’ossido borico svolge un ruolo cruciale nella produzione di semiconduttori. Agisce come materiale drogante per modificare attivamente le proprietà elettriche del silicio.
L’ampia gamma di applicazioni dell’ossido borico ne evidenzia la versatilità e l’importanza in vari settori, contribuendo ai progressi nella tecnologia, nella sicurezza e nella scienza dei materiali.
Domande:
D: Qual è lo stato di ossidazione del boro in B2O3?
R: Lo stato di ossidazione del boro in B2O3 è +3.
D: Qual è la formula empirica per l’ossido di boro?
R: La formula empirica per l’ossido borico è B2O3.
D: Quando la concentrazione superficiale del boro influenzerà il tasso di crescita dell’ossido?
R: La concentrazione superficiale del boro influenzerà il tasso di crescita dell’ossido quando agisce come drogante o catalizzatore nel processo di ossidazione.
D: Cos’è l’ossido di boro Boria?
R: L’ossido borico, noto anche come boria, è un composto con la formula chimica B2O3.
D: Qual è il numero di ossidazione del boro?
R: Il boro ha generalmente un numero di ossidazione pari a +3.
D: Il boro rallenterà l’ossidazione nei materiali privi di ossigeno?
R: Il boro non rallenta l’ossidazione nei materiali privi di ossigeno perché richiede ossigeno per formare ossido borico.
D: Qual è lo stato di ossidazione del boro nell’HBO2 in CuO?
R: Lo stato di ossidazione del boro nell’HBO2 è +3.
D: Quante moli di B2O3 si possono formare?
R: Il numero di moli di B2O3 formate dipende dalla quantità di reagenti utilizzati nella reazione.
D: B2O3 è ionico o molecolare?
R: B2O3 è un composto ionico.
D: Quale coppia è elencata in ordine di basicità crescente? PBO < SiO2 B2O3 < Li2O
R: La coppia elencata in ordine di basicità crescente è B2O3 < Li2O < PBO < SiO2.
D: B2H6 + O2 → B2O3 + H2O, questa equazione è bilanciata?
R: No, l’equazione non è equilibrata. Ciò richiede aggiustamenti per raggiungere un’equazione equilibrata.
D: Quanto boro puoi ottenere da 210 libbre di B2O3?
R: La quantità di boro ottenuta da 210,0 libbre di B2O3 dipende dalla massa molare e dalla stechiometria della reazione.
