Il bicarbonato di ammonio è un composto cristallino bianco utilizzato nella cottura come agente lievitante. Rilascia anidride carbonica quando riscaldato, dando vita a prodotti da forno leggeri e soffici.
| Nome IUPAC | Bicarbonato di ammonio |
| Formula molecolare | NH4HCO3 |
| numero CAS | 1066-33-7 |
| Sinonimi | Carbonato acido di ammonio; ammoniaca da forno; Sale di ammonio dell’acido carbonico (1:1); Idrogenocarbonato di ammonio |
| InChI | InChI=1S/CH2O3.H3N/c2-1(3)4;/h(H2,2,3,4);1H3 |
Si tenga presente che il valore InChI fornito è una rappresentazione semplificata e potrebbe non essere completa.
Proprietà del bicarbonato di ammonio
Formula di bicarbonato di ammonio
La formula chimica del bicarbonato di ammonio è NH4HCO3. È costituito da uno ione ammonio (NH4+) e uno ione bicarbonato (HCO3-). Questa formula rappresenta la composizione del composto, indicando la presenza di gruppi ammonio e bicarbonato.
Massa molare del bicarbonato di ammonio
La massa molare dell’idrogenocarbonato di ammonio si calcola sommando le masse atomiche dei suoi elementi costitutivi. Per il carbonato acido di ammonio (NH4HCO3), la massa molare è di circa 79,06 grammi per mole. Questo valore è importante per vari calcoli e conversioni chimiche.
Punto di ebollizione del bicarbonato di ammonio
Il carbonato acido di ammonio non ha un punto di ebollizione distinto perché si decompone in prodotti gassosi quando riscaldato. Tuttavia, il processo di decomposizione inizia intorno ai 60-70 gradi Celsius. All’aumentare della temperatura, il composto si scompone in ammoniaca (NH3), acqua (H2O) e anidride carbonica (CO2).
Punto di fusione del bicarbonato di ammonio
Il punto di fusione del carbonato acido di ammonio è di circa 41-60 gradi Celsius. Quando riscaldato, il composto subisce una sublimazione, passando direttamente dallo stato solido allo stato gassoso senza passare attraverso la fase liquida.
Densità del bicarbonato di ammonio g/mL
La densità dell’idrogenocarbonato di ammonio è di circa 1,59 grammi per millilitro (g/ml) a temperatura ambiente. Questo valore rappresenta la massa del composto per unità di volume. La densità dell’idrogenocarbonato di ammonio influenza il suo comportamento in varie applicazioni e la sua solubilità in diversi solventi.
Peso molecolare del bicarbonato di ammonio
Il peso molecolare dell’idrogenocarbonato di ammonio è di circa 79,06 grammi per mole. Questo valore si ottiene sommando le masse atomiche degli elementi presenti nel composto (azoto, idrogeno, carbonio e ossigeno). Il peso molecolare è essenziale per calcolare la quantità di carbonato acido di ammonio necessaria per le reazioni chimiche.
Struttura del bicarbonato di ammonio
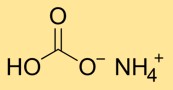
Il carbonato acido di ammonio ha una struttura cristallina composta da ioni ammonio (NH4+) e bicarbonato (HCO3-). Lo ione ammonio è formato dalla combinazione di un atomo di azoto e quattro atomi di idrogeno, mentre lo ione bicarbonato è costituito da un atomo di carbonio legato a tre atomi di ossigeno.
Solubilità del bicarbonato di ammonio
Il carbonato acido di ammonio è molto solubile in acqua. Si dissolve facilmente in soluzioni acquose liberando ioni ammonio e ioni bicarbonato. Tuttavia, la sua solubilità diminuisce con la temperatura. È scarsamente solubile in alcool e insolubile nella maggior parte dei solventi organici.
| Aspetto | Polvere cristallina bianca |
| Peso specifico | 1.586 g/cm³ |
| Colore | Incolore |
| Odore | Odore di ammoniaca |
| Massa molare | 79,06 g/mole |
| Densità | 1,59 g/ml |
| Punto di fusione | 41-60°C |
| Punto di ebollizione | Decomposto |
| Punto flash | Non applicabile |
| solubilità in acqua | Solubile |
| Solubilità | Solubile in acqua; scarsamente solubile in alcool |
| Pressione del vapore | Non applicabile |
| Densità del vapore | Non applicabile |
| pKa | Non applicabile |
| pH | ~7 |
Si prega di notare che i valori forniti sono approssimativi e possono variare a seconda di fattori quali purezza e condizioni ambientali.
Sicurezza e pericoli del bicarbonato di ammonio
Il carbonato acido di ammonio presenta alcune considerazioni e pericoli sulla sicurezza. Può irritare gli occhi, la pelle e il sistema respiratorio per contatto o inalazione. L’esposizione diretta può causare disagio, inclusa sensazione di bruciore. È importante maneggiare il composto con cura e utilizzare adeguati dispositivi di protezione individuale, come guanti e occhiali. Inoltre, il carbonato acido di ammonio può rilasciare gas di ammoniaca dannoso quando riscaldato, quindi in tali situazioni è necessaria un’adeguata ventilazione. Il composto non è infiammabile e non ha punto di infiammabilità specifico. Una corretta conservazione, etichettatura e aderenza ai protocolli di sicurezza sono essenziali per ridurre al minimo i rischi associati alla manipolazione e all’uso del carbonato acido di ammonio.
| Simboli di pericolo | Xi (irritante) |
| Descrizione della sicurezza | – Evitare il contatto con gli occhi, la pelle e l’inalazione.\n- Utilizzare dispositivi di protezione individuale adeguati.\n- Garantire un’adeguata ventilazione durante la manipolazione.\n- Conservare correttamente ed etichettare i contenitori.\n – Seguire i protocolli di sicurezza. |
| Numeri di identificazione delle Nazioni Unite | Non applicabile |
| Codice SA | 28369990 |
| Classe di pericolo | Non classificato |
| Gruppo di imballaggio | Non classificato |
| Tossicità | Bassa tossicità; irritante per gli occhi, la pelle e il sistema respiratorio. |
Si prega di notare che le informazioni fornite sono di natura generale e potrebbero non coprire tutti gli aspetti della sicurezza e dei rischi del carbonato acido di ammonio. È importante fare riferimento alle specifiche schede tecniche e normative di sicurezza per una guida completa.
Metodi per la sintesi del bicarbonato di ammonio
Esistono diversi metodi per sintetizzare il carbonato acido di ammonio.
Un metodo comune prevede la reazione tra ammoniaca gassosa (NH3) e anidride carbonica (CO2) in una soluzione acquosa. In questo processo, si fanno bollire i due gas direttamente nell’acqua e l’acqua forma una soluzione di idrogenocarbonato di ammonio. Successivamente si concentra e si cristallizza la soluzione per ottenere il composto solido.
Un altro approccio è la reazione tra ammoniaca e anidride carbonica in un solvente, come metanolo o etanolo. La reazione avviene sotto pressione e ad alta temperatura, dando luogo alla formazione di cristalli di idrogenocarbonato di ammonio.
Il trattamento del carbonato di ammonio con anidride carbonica produce bicarbonato di ammonio e acqua. Il carbonato di ammonio , sia nella sua forma solida che in soluzione, reagisce con l’anidride carbonica per produrre bicarbonato di ammonio.
Per sintetizzare l’idrogenocarbonato di ammonio, l’ammoniaca può essere combinata con l’acido carbonico. L’acido carbonico si forma sciogliendo l’anidride carbonica in acqua e l’aggiunta di ammoniaca alla soluzione di acido carbonico risultante produce idrogenocarbonato di ammonio.
Assicurarsi che la sintesi dell’idrogenocarbonato di ammonio avvenga in un’area ben ventilata a causa del rilascio di gas di ammoniaca durante le reazioni. Seguire le precauzioni di sicurezza e i protocolli di manipolazione adeguati per garantire un processo di sintesi sicuro ed efficiente.
Usi del bicarbonato di ammonio
Il carbonato acido di ammonio trova vari usi in diversi settori e applicazioni. Ecco alcuni dei suoi usi comuni:
- Cottura: il carbonato acido di ammonio viene utilizzato come agente lievitante nella cottura al forno, in particolare per biscotti, cracker e altri prodotti da forno. Rilascia anidride carbonica quando riscaldato, creando una consistenza leggera e croccante.
- Produzione di ammoniaca: il carbonato acido di ammonio funge da composto intermedio nella produzione di ammoniaca. Può scomporsi in ammoniaca e anidride carbonica, che possono poi essere separati e utilizzati per vari scopi.
- Agricoltura: gli agricoltori lo utilizzano come fonte di azoto nei fertilizzanti per fornire nutrienti essenziali per la crescita delle piante. Le piante lo assorbono facilmente grazie alla sua solubilità in acqua.
- Controllo del pH: le industrie utilizzano il carbonato acido di ammonio per regolare i livelli di pH in processi quali il trattamento delle acque, la produzione di coloranti e la produzione di pigmenti.
- Estintori: alcuni estintori a polvere secca utilizzano questo composto come estintore. Soffoca le fiamme e interrompe il processo di combustione.
- Agente detergente: alcune industrie lo utilizzano come detergente per rimuovere sporco, grasso e contaminanti dalle superfici.
- Industria tessile e della pelle: nei processi di tintura e stampa di tessuti e pelletteria, il carbonato acido di ammonio aiuta a fissare i coloranti e a migliorare la solidità del colore.
- Applicazioni farmaceutiche: trova applicazione in alcune formulazioni farmaceutiche come agente tampone o ingrediente in compresse medicinali.
Le diverse applicazioni dell’idrogenocarbonato di ammonio ne evidenziano la versatilità e l’utilità in molteplici settori, tra cui panificazione, agricoltura, controllo del pH, soppressione degli incendi e vari processi di produzione.
Domande:
D: Il bicarbonato di ammonio fa male?
R: Il carbonato acido di ammonio può essere dannoso se ingerito o inalato in grandi quantità, causando irritazione al sistema respiratorio e alla pelle. Dovrebbe essere maneggiato e utilizzato con le dovute precauzioni.
D: Come separare il carbonato di ammonio dal bicarbonato di ammonio?
R: Il carbonato di ammonio può essere separato dal carbonato acido di ammonio riscaldando la miscela, perché il bicarbonato di ammonio si scompone in ammoniaca, anidride carbonica e acqua, lasciando dietro di sé il carbonato di ammonio.
D: Come si calcola il pH del bicarbonato di ammonio nell’acqua?
R: Il pH del carbonato acido di ammonio nell’acqua può essere calcolato utilizzando l’equazione di Henderson-Hasselbalch: pH = pKa + log([A-]/[HA]), dove pKa è la costante di dissociazione acida e [A-]/[ HA] rappresenta il rapporto tra la base coniugata e l’acido.
D: Come posso regolare il pH del tampone di bicarbonato di ammonio?
R: Il pH di un tampone di idrogenocarbonato di ammonio può essere regolato aggiungendo un acido forte per abbassare il pH o una base forte per aumentare il pH mantenendo il rapporto appropriato tra bicarbonato di ammonio e base coniugata.
D: Il bicarbonato di ammonio è sicuro negli alimenti?
R: Il carbonato acido di ammonio è generalmente riconosciuto come sicuro (GRAS) per l’uso negli alimenti, ma deve essere utilizzato secondo le linee guida normative e in quantità adeguate.
D: Cos’è un tampone a base di bicarbonato di ammonio?
R: Il tampone idrogenocarbonato di ammonio è una soluzione contenente idrogenocarbonato di ammonio e la sua base coniugata (o acido), utilizzata per mantenere un pH stabile in varie applicazioni biochimiche e biologiche.
D: Qual è la massa molecolare del bicarbonato di ammonio?
R: La massa molecolare dell’idrogenocarbonato di ammonio è di circa 79,06 g/mol.
D: Qual è la composizione percentuale in massa dell’idrogeno in NH4HCO3?
R: La composizione percentuale in massa dell’idrogeno in NH4HCO3 è di circa il 6,57%.
D: NH4HCO3 è un acido o una base?
R: NH4HCO3 può agire sia come acido che come base, a seconda del contesto. Può donare un protone (H+) per agire come un acido o accettare un protone per agire come base.
D: Qual è il nome del composto con la formula NH4HCO3?
R: Il composto con la formula NH4HCO3 è chiamato idrogenocarbonato di ammonio.
D: NH4HCO3 è ionico o covalente?
R: NH4HCO3 è considerato un composto ionico a causa della presenza dello ione ammonio (NH4+) e dello ione idrogenocarbonato (HCO3-) nella sua struttura.
