L’idrossido di nichel (Ni(OH)2) è un composto chimico composto da ioni nichel e idrossido. È comunemente usato come precursore delle batterie a base di nichel.
| Nome dell’IUPAC | Idrossido di nichel |
| Formula molecolare | Ni(OH)2 |
| numero CAS | 12054-48-7 |
| Sinonimi | Idrossido di nichel(II); Idrossido di nichel; Triossido di azoto e nichel (2+) |
| InChI | InChI=1S/Ni.2H2O/h;2*1H2/q+2;;/p-2 |
Proprietà dell’idrossido di nichel
Formula dell’idrossido di nichel
La formula dell’idrossido di nichel è Ni(OH)2. È costituito da uno ione nichel (Ni) e due ioni idrossido (OH-). Questa formula chimica rappresenta la composizione dell’idrossido di nichel a livello atomico.
Massa molare dell’idrossido di nichel
La massa molare del Ni(OH)2 si calcola sommando le masse atomiche dei suoi elementi costitutivi. Il nichel ha una massa atomica di 58,6934 g/mol e ciascuno ione idrossido ha una massa di 17,007 g/mol. Sommandoli, la massa molare di Ni(OH)2 è di circa 92,6934 g/mol.
Punto di ebollizione dell’idrossido di nichel
Ni(OH)2 non ha un punto di ebollizione ben definito perché si decompone quando riscaldato. Ad alte temperature subisce una decomposizione termica e si trasforma in ossido di nichel (NiO) e vapore acqueo.
Punto di fusione dell’idrossido di nichel
Il punto di fusione del Ni(OH)2 è di circa 230°C. A questa temperatura, Ni(OH)2 subisce un cambiamento di fase dallo stato solido a quello liquido. Il composto si scioglie, consentendo ulteriori reazioni chimiche o trattamenti.
Densità dell’idrossido di nichel g/mL
La densità di Ni(OH)2 è di circa 4,1 g/mL. Questo valore rappresenta la massa del composto per unità di volume. Indica la compattezza o concentrazione di Ni(OH)2 in un dato spazio.
Peso molecolare dell’idrossido di nichel
Il peso molecolare del Ni(OH)2 viene determinato sommando i pesi atomici dei suoi elementi costitutivi. Il nichel ha un peso atomico di 58,6934 g/mol e ciascuno ione idrossido pesa 17,007 g/mol. Pertanto, il peso molecolare di Ni(OH)2 è di circa 92,6934 g/mol.
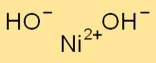
Struttura dell’idrossido di nichel
Ni(OH)2 cristallizza nel sistema cristallino esagonale. Forma strati di ioni Ni+2 e OH- impilati uno sopra l’altro. Gli ioni Ni+2 sono circondati da ioni OH- in modo coordinato, creando una struttura a rete.
Solubilità dell’idrossido di nichel
Ni(OH)2 è scarsamente solubile in acqua. Si dissolve in una certa misura, formando una soluzione leggermente alcalina a causa della presenza di ioni idrossido. La solubilità di Ni(OH)2 può essere influenzata da fattori quali temperatura e pH.
| Aspetto | Verde fisso |
| Peso specifico | 4,1 g/ml |
| Colore | Verde |
| Odore | Inodore |
| Massa molare | 92,6934 g/mole |
| Densità | 4,1 g/ml |
| Punto di fusione | 230°C |
| Punto di ebollizione | Decomposto |
| Punto flash | N / A |
| solubilità in acqua | Leggermente solubile |
| Solubilità | Insolubile, forma una soluzione alcalina in acqua |
| Pressione del vapore | N / A |
| Densità del vapore | N / A |
| pKa | N / A |
| pH | Alcalino |
Sicurezza e pericoli dell’idrossido di nichel
Ni(OH)2 presenta alcuni rischi per la sicurezza che devono essere considerati. Può irritare la pelle, gli occhi e il sistema respiratorio per contatto o inalazione. L’esposizione prolungata o ripetuta può provocare sensibilizzazione, causando reazioni allergiche. È importante maneggiare Ni(OH)2 con cura, utilizzando misure protettive adeguate come guanti, occhiali e un respiratore. In caso di ingestione o esposizione accidentale, è necessario consultare immediatamente un medico. Inoltre, Ni(OH)2 è considerato un pericolo ambientale e deve essere smaltito correttamente secondo le normative per prevenire la contaminazione del suolo o delle fonti d’acqua.
| Simboli di pericolo | Nessuno |
| Descrizione della sicurezza | – Può causare irritazione alla pelle e agli occhi\n- Può causare irritazione alle vie respiratorie\n- Possibile sensibilizzazione\n- Seguire le procedure corrette di manipolazione e smaltimento |
| Numeri di identificazione delle Nazioni Unite | Non applicabile |
| Codice SA | 2825.70.10 |
| Classe di pericolo | Non classificato come pericoloso |
| Gruppo di imballaggio | Non applicabile |
| Tossicità | Considerata tossicità da bassa a moderata |
Si prega di notare che i simboli di pericolo e gli identificatori ONU non si applicano al Ni(OH)2 poiché non è classificato come sostanza pericolosa. La descrizione della sicurezza fornita evidenzia i potenziali rischi e le precauzioni associati alla manipolazione del Ni(OH)2. La tossicità del Ni(OH)2 è generalmente considerata da bassa a moderata.
Metodi di sintesi dell’idrossido di nichel
Sono disponibili diversi metodi sintetici per la produzione di Ni(OH)2. Un metodo comune prevede la reazione tra un sale di nichel solubile, come solfato di nichel o nitrato di nichel, e un idrossido alcalino, solitamente idrossido di sodio o idrossido di potassio. La reazione avviene in una soluzione acquosa in condizioni controllate, dando luogo alla formazione di Ni(OH)2 come precipitato.
Nel metodo di deposizione elettrochimica, la cella elettrolitica utilizza nichel metallico come elettrodo. Applica un’adeguata corrente elettrica per ridurre gli ioni nichel dall’elettrolita e depositarli sull’elettrodo sotto forma di Ni(OH)2. Questo metodo consente un controllo preciso della composizione e della morfologia del Ni(OH)2 risultante.
La decomposizione termica dei sali di nichel consente la produzione di Ni(OH)2. Riscaldando un sale di nichel, come il carbonato di nichel o lo stesso Ni(OH)2, in un ambiente controllato, il composto subisce una decomposizione, producendo Ni(OH)2 e altri sottoprodotti.
Vale la pena ricordare che la scelta del metodo di sintesi dipende da fattori quali la purezza desiderata, la dimensione delle particelle e i requisiti applicativi specifici. Quando si seleziona il percorso sintetico appropriato per la produzione di Ni(OH)2, è necessario considerare attentamente il risultato desiderato a causa dei vantaggi e dei limiti associati a ciascun metodo.
Usi dell’idrossido di nichel
Ni(OH)2 trova varie applicazioni grazie alle sue proprietà uniche. Ecco alcuni usi comuni di Ni(OH)2:
- Produzione di batterie: il Ni(OH)2 svolge un ruolo cruciale come materiale catodico nelle batterie a base di nichel, come le batterie al nichel-cadmio (NiCd) e al nichel-metallo idruro (NiMH). Immagazzina e rilascia energia elettrica, consentendo un efficiente stoccaggio dell’energia.
- Catalizzatore: Ni(OH)2 agisce come catalizzatore in varie reazioni chimiche, inclusi i processi di idrogenazione e ossidazione. Le sue proprietà catalitiche facilitano la conversione efficiente dei reagenti nei prodotti desiderati.
- Galvanotecnica: Ni(OH)2 forma uno strato di nichel stabile e aderente, che lo rende prezioso nelle applicazioni di galvanica. Fornisce un rivestimento protettivo, resistente alla corrosione ed esteticamente gradevole su varie superfici metalliche.
- Pigmenti: i produttori utilizzano Ni(OH)2 come pigmento verde nella produzione di ceramica, vetro e plastica. Il suo vibrante colore verde esalta il valore estetico di questi materiali.
- Sensori di gas: i sensori basati su Ni(OH)2 rilevano e monitorano gas come idrogeno, ammoniaca e idrogeno solforato. I cambiamenti nella conduttività elettrica nelle pellicole di Ni(OH)2 consentono il rilevamento efficiente di questi gas.
- Trattamento dell’acqua: Ni(OH)2 favorisce i processi di trattamento dell’acqua assorbendo e rimuovendo selettivamente i contaminanti dei metalli pesanti, come piombo e cadmio. Presenta un’affinità per questi metalli, rendendolo utile per la loro rimozione dalle fonti d’acqua.
- Applicazioni farmaceutiche: Ni(OH)2 trova applicazione nelle formulazioni farmaceutiche, fungendo da legante, disintegrante o regolatore del pH nelle formulazioni in compresse o capsule.
Questi sono solo alcuni esempi delle varie applicazioni del Ni(OH)2, a dimostrazione della sua versatilità e importanza in vari settori.
Domande:
D: Qual è la formula chimica dell’idrossido basico di nichel (II)?
R: La formula chimica dell’idrossido di nichel(II) è Ni(OH)2.
D: L’idrossido di nichel è solubile in acqua?
R: Ni(OH)2 è insolubile in acqua.
D: Quanti grammi di cloruro di nichel (II) sono necessari per neutralizzare 75,0 ml di idrossido di litio 0,555 M?
R: I grammi di cloruro di nichel richiesti possono essere calcolati utilizzando la stechiometria e la molarità della soluzione di idrossido di litio.
D: Quale carica rappresenta Ni(OH)2?
R: La carica di Ni(OH)2 è neutra o zero.
D: Come calcolare la solubilità molare di Ni(OH)2?
R: La solubilità molare di Ni(OH)2 può essere determinata dividendo il numero di moli di composto disciolto per il volume della soluzione.
D: Qual è la forma bilanciata dell’equazione NaOH(aq) + NiCl2(aq) → NaCl(aq) + Ni(OH)2(s)?
R: L’equazione bilanciata è 2NaOH(aq) + NiCl2(aq) → 2NaCl(aq) + Ni(OH)2(s).
D: Quanti grammi per mole sono Ni(OH)2?
R: La massa molare di Ni(OH)2 è circa 92,6934 g/mol.
D: Ni(OH)2 è solubile in acqua?
R: No, Ni(OH)2 è insolubile in acqua.
D: Qual è l’agente riducente nella reazione: Mg + NiO2 + 2H2O → Mg(OH)2 + Ni(OH)2?
R: L’agente riducente nella reazione è il magnesio (Mg).
D: Ni(OH)2 è un solido?
R: Sì, Ni(OH)2 è un composto solido.
D: Se la cella ha un potenziale di 0,247 V a 25°C, qual è il Ksp di Ni(OH)2?
R: La Ksp di Ni(OH)2 può essere determinata utilizzando l’equazione di Nernst e il potenziale di cella.
D: Quali sali saranno più solubili in una soluzione acida che in acqua pura?
R: Sali come Ni(OH)2 saranno più solubili in una soluzione acida a causa della reazione di neutralizzazione con l’acido.
