Il cloruro di nichel (II), noto come NiCl2, è un composto chimico giallo-verdastro. È comunemente usato nella galvanica, nei catalizzatori e come precursore nella sintesi di altri composti del nichel.
| Nome dell’IUPAC | Cloruro di nichel (II). |
| Formula molecolare | NiCl2 |
| numero CAS | 7718-54-9 |
| Sinonimi | Cloruro di nichel, dicloruro di nichel, dicloronichel, cloruro di nichel |
| InChI | InChI=1S/2ClH.Ni/h2*1H;/q;;+2/p-2 |
Proprietà del cloruro di nichel
Formula del cloruro di nichel
La formula del dicloruro di nichel è NiCl2. Ciò indica che ciascuna molecola di dicloruro di nichel è costituita da un atomo di nichel legato a due atomi di cloro. Questa formula chimica fornisce informazioni importanti sulla composizione e sul rapporto degli elementi presenti nel composto.
Massa molare del cloruro di nichel
La massa molare del dicloruro di nichel, calcolata sommando le masse atomiche dei suoi elementi costitutivi, è di circa 129,6 grammi per mole. Questo valore è utile per determinare la quantità di dicloruro di nichel presente in un dato campione e per vari calcoli stechiometrici.
Punto di ebollizione del cloruro di nichel
Il dicloruro di nichel ha un punto di ebollizione di circa 1.007 gradi Celsius (1.845 gradi Fahrenheit). A questa temperatura il composto subisce una transizione di fase dallo stato liquido allo stato gassoso. Il punto di ebollizione è un’importante proprietà fisica che aiuta a comprendere il comportamento del dicloruro di nichel quando riscaldato.
Punto di fusione del cloruro di nichel
Il punto di fusione del dicloruro di nichel è di circa 1.002 gradi Celsius (1.836 gradi Fahrenheit). Questa è la temperatura alla quale la forma solida del dicloruro di nichel passa allo stato liquido. Il punto di fusione è importante per le applicazioni che comportano la manipolazione e la lavorazione del dicloruro di nichel.
Densità del cloruro di nichel g/mL
La densità del dicloruro di nichel è di circa 3,55 grammi per millilitro. La densità è una misura della massa per unità di volume di una sostanza e fornisce informazioni sulla compattezza del materiale. La densità del dicloruro di nichel aiuta a determinarne il comportamento in varie applicazioni e in diversi stati fisici.
Peso molecolare del cloruro di nichel
Il peso molecolare del dicloruro di nichel è di circa 129,6 grammi per mole. Si calcola sommando le masse atomiche del nichel e del cloro presenti nel composto. Il peso molecolare è essenziale per comprendere le relazioni tra massa, moli e numero di particelle nelle reazioni chimiche.
Struttura del cloruro di nichel
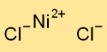
Il dicloruro di nichel adotta una struttura reticolare cristallina nella sua forma solida. È costituito da cationi nichel (Ni2+) e anioni cloruro (Cl-) disposti alternativamente. Questa disposizione forma una rete tridimensionale che contribuisce alla stabilità e alle proprietà fisiche del dicloruro di nichel.
Solubilità del cloruro di nichel
Il dicloruro di nichel ha una moderata solubilità in acqua. Può dissolversi per formare una soluzione giallo-verdastra. La solubilità del dicloruro di nichel è influenzata da fattori quali la temperatura e la presenza di altre sostanze. Comprenderne la solubilità è importante in vari processi industriali e applicazioni chimiche che coinvolgono il dicloruro di nichel.
| Aspetto | Solido giallo verdastro |
| Peso specifico | 3,55 g/ml |
| Colore | giallo verdastro |
| Odore | Inodore |
| Massa molare | 129,6 g/mole |
| Densità | 3,55 g/ml |
| Punto di fusione | 1002°C (1836°F) |
| Punto di ebollizione | 1007°C (1845°F) |
| Punto flash | Non applicabile |
| solubilità in acqua | Moderare |
| Solubilità | Solubile in solventi organici (etanolo, acetone) e acidi |
| Pressione del vapore | Non disponibile |
| Densità del vapore | Non disponibile |
| pKa | Non disponibile |
| pH | Acido (circa 4) |
Sicurezza e pericoli del cloruro di nichel
Il dicloruro di nichel presenta alcuni rischi per la sicurezza che devono essere considerati. È importante maneggiare questo composto con cura per evitare potenziali rischi. Il dicloruro di nichel può causare irritazione e sensibilizzazione della pelle, pertanto è necessario indossare guanti e indumenti protettivi durante la manipolazione. Evitare l’inalazione di polvere o vapori di dicloruro di nichel poiché ciò potrebbe causare irritazione respiratoria. L’ingestione di dicloruro di nichel può essere dannosa e dovrebbe essere evitata. Inoltre, il dicloruro di nichel è tossico per la vita acquatica e può causare danni ambientali se rilasciato nei corpi idrici. È necessario seguire procedure adeguate di stoccaggio, manipolazione e smaltimento per ridurre al minimo i rischi associati al dicloruro di nichel.
| Simboli di pericolo | Corrosivo, nocivo, pericolo ambientale |
| Descrizione della sicurezza | – Indossare guanti e indumenti protettivi – Evitare l’inalazione di polvere o vapori – Prevenire l’ingestione – Conservare, maneggiare e smaltire correttamente |
| Identificatori delle Nazioni Unite | UN3288 |
| Codice SA | 2827.39.80 |
| Classe di pericolo | 8 (Corrosivo) |
| Gruppo di imballaggio | III |
| Tossicità | Nocivo se ingerito, provoca irritazione alla pelle e agli occhi |
Metodi di sintesi del cloruro di nichel
Esistono diversi metodi per sintetizzare il dicloruro di nichel, ciascuno con i propri vantaggi e applicazioni.
Un metodo comune prevede la reazione del nichel metallico o dell’ossido di nichel con acido cloridrico. In questo processo, nichel metallico o ossido di nichel vengono aggiunti in un contenitore adatto e agitati mentre si aggiunge lentamente acido cloridrico. La reazione tra nichel e acido produce dicloruro di nichel e il rilascio di gas idrogeno.
Un altro metodo di sintesi prevede la reazione tra carbonato di nichel e acido cloridrico. L’acido cloridrico dissolve il carbonato di nichel e la soluzione riscaldata subisce una reazione per formare dicloruro di nichel e rilasciare gas di anidride carbonica.
L’acido cloridrico subisce una reazione con l’idrossido di nichel disciolto quando la soluzione viene riscaldata o lasciata riposare, determinando la sintesi del dicloruro di nichel. La reazione porta alla formazione di dicloruro di nichel e acqua.
Inoltre, il dicloruro di nichel può essere preparato facendo reagire il nichel metallico con cloro gassoso. Questa reazione diretta tra i due elementi dà il dicloruro di nichel.
Questi metodi di sintesi offrono diversi percorsi per ottenere il dicloruro di nichel, consentendo flessibilità in termini di materie prime e condizioni di reazione. La scelta del metodo dipende da fattori quali la purezza desiderata del prodotto finale, la disponibilità delle materie prime e i requisiti applicativi specifici.
Usi del cloruro di nichel
Il bicloruro di nichel ha varie applicazioni in diversi settori grazie alle sue proprietà uniche. Ecco alcuni dei suoi usi notevoli:
- Galvanotecnica: i processi di galvanostegia utilizzano tipicamente il dicloruro di nichel per fornire un rivestimento protettivo e decorativo su varie superfici. Il dicloruro di nichel migliora l’aspetto di metalli come acciaio, ottone e rame fornendo allo stesso tempo resistenza alla corrosione.
- Catalizzatore: il dicloruro di nichel agisce come catalizzatore in molte reazioni chimiche, compresi i processi di idrogenazione e polimerizzazione. Facilita la conversione dei reagenti nei prodotti desiderati e trova applicazione nella produzione di prodotti farmaceutici, plastica e fibre sintetiche.
- Sintesi chimica: il dicloruro di nichel funge da precursore nella sintesi di vari composti di nichel, come l’ossido di nichel, il solfuro di nichel e il cianuro di nichel. Le industrie utilizzano questi composti in catalizzatori, pigmenti, ceramiche e materiali magnetici.
- Batterie: le batterie ricaricabili, in particolare le batterie al nichel-metallo idruro (NiMH), utilizzano il dicloruro di nichel come elettrolita. Permette la circolazione degli ioni tra gli elettrodi durante i cicli di carica e scarica.
- Purificazione del gas: le industrie utilizzano il dicloruro di nichel nei processi di purificazione del gas per rimuovere impurità come l’idrogeno solforato e il monossido di carbonio. Trova applicazioni nella raffinazione del gas naturale e nella lavorazione petrolchimica.
- Supplemento per mangimi per animali: i mangimi per il bestiame, in particolare quelli per pollame e suini, incorporano dicloruro di nichel come integratore nutrizionale. Facilita l’attività enzimatica e contribuisce alla salute generale e alla crescita degli animali.
- Ricerca di laboratorio: i ricercatori utilizzano il dicloruro di nichel in una varietà di esperimenti di laboratorio, comprese le reazioni catalizzate dal nichel e come fonte di ioni nichel per l’analisi chimica.
Queste diverse applicazioni dimostrano la versatilità e l’importanza del dicloruro di nichel in settori che vanno dalla produzione e dall’energia all’agricoltura e alla ricerca.
Domande:
D: Quali ioni sono presenti in una soluzione acquosa di NiCl2?
R: In una soluzione acquosa di NiCl2, gli ioni presenti sono Ni2+ (catione nichel) e Cl- (anione cloruro).
D: NiCl2 è solubile in acqua?
R: Sì, NiCl2 è solubile in acqua e forma una soluzione acquosa giallo-verdastra.
D: Quale metallo reagisce spontaneamente con NiCl2(aq)?
R: Metalli come magnesio (Mg) e zinco (Zn) reagiscono spontaneamente con NiCl2(aq) per sostituire il nichel e formare i rispettivi cloruri.
D: NiCl2 è polare o non polare?
R: NiCl2 è un composto polare a causa della differenza di elettronegatività tra nichel e cloro, che si traduce in una distribuzione ineguale della carica.
D: NiCl2 è acquoso?
R: Sì, NiCl2 può esistere allo stato acquoso quando disciolto in acqua, formando una soluzione acquosa.
D: Qual è il nome del composto con la formula NiCl2?
R: Il composto con la formula NiCl2 è chiamato cloruro di nichel (II).
D: Come prepareresti 1,00 L di una soluzione NiCl2 0,50 M?
R: Per preparare una soluzione 0,50 M di NiCl2, sciogliere 129,6 grammi di NiCl2 in acqua e portare il volume a 1,00 L.
D: Qual è il sale insolubile che si forma tra una soluzione di Na2S e NiCl2?
R: Quando una soluzione di Na2S viene miscelata con NiCl2, si forma solfuro di nichel insolubile (NiS).
D: NiCl2(aq) è un solido?
R: No, NiCl2(aq) si riferisce ad una soluzione acquosa di NiCl2, il che indica che è in forma liquida.
D: Cosa rende verde il cloruro cristallino di nichel (II)?
R: Il colore verde del cloruro cristallino di nichel (II) è attribuito alla presenza di cationi di nichel (Ni2+) nel reticolo cristallino.
D: Il dicloruro di nichel è tossico?
R: Sì, il dicloruro di nichel è tossico e deve essere maneggiato con cautela. Può causare irritazioni alla pelle e problemi respiratori ed è nocivo se ingerito.
D: Si verifica una reazione quando si combinano soluzioni acquose di NiCl2 e Na2S?
R: Sì, si verifica una reazione quando si combinano soluzioni acquose di NiCl2 e Na2S, con conseguente formazione di solfuro di nichel insolubile (NiS) e cloruro di sodio solubile (NaCl).
D: Quanti grammi di NiCl2 sono necessari per neutralizzare 75,0 ml di idrossido di litio 0,555 M?
R: Sono necessari circa 18,4 grammi di NiCl2 per neutralizzare 75,0 ml di idrossido di litio 0,555 M in una reazione stechiometrica.
D: Cosa succede quando si mescolano carbonato di ammonio, dicloruro di nichel e acqua?
R: Quando si mescolano carbonato di ammonio, dicloruro di nichel e acqua, si verifica una reazione che porta alla formazione di cloruro di ammonio, carbonato di nichel e acqua.
