Il solfato di nichel (NiSO4) è un composto costituito da atomi di nichel, zolfo e ossigeno. È comunemente usato nella galvanica, nei catalizzatori e come nutriente in alcuni fertilizzanti.
| Nome IUPAC | Solfato di nichel (II). |
| Formula molecolare | NiSO4 |
| numero CAS | 7786-81-4 |
| Sinonimi | Solfato di nichel, sale di nichel dell’acido solforico, solfato di nichel (II), nichel (2+); solfato |
| InChI | InChI=1S/Ni.H2O4S/c;1-5(2,3)4/h;(H2,1,2,3,4)/q+2;/p-2 |
Proprietà del solfato di nichel
Formula di solfato di nichel
La formula chimica del solfato di nichel è NiSO4. Rappresenta la combinazione di un atomo di nichel (Ni) e un gruppo solfato (SO4). La formula indica chiaramente la presenza di nichel e zolfo, nonché ossigeno nel gruppo solfato.
Massa molare del solfato di nichel
La massa molare del solfato di nichel (NiSO4) si calcola sommando le masse atomiche dei suoi elementi costitutivi. Il nichel (Ni) ha una massa atomica di circa 58,69 grammi per mole, mentre lo zolfo (S) ha una massa atomica di circa 32,07 grammi per mole e l’ossigeno (O) ha una massa atomica di circa 16 grammi per mole. Sommando questi valori, si determina che la massa molare del solfato di nichel è pari a circa 154,76 grammi per mole.
Punto di ebollizione del solfato di nichel
Il solfato di nichel non ha un punto di ebollizione specifico perché si decompone se riscaldato. È importante però notare che la sua temperatura di decomposizione è influenzata da fattori quali la pressione e la presenza di altre sostanze. Pertanto, si consiglia di maneggiare il solfato di nichel con cautela se esposto a temperature elevate.
Solfato di nichel Punto di fusione
Il punto di fusione del solfato di nichel è di circa 100 gradi Celsius (212 gradi Fahrenheit). A questa temperatura, la forma solida del solfato di nichel passa allo stato liquido. Vale la pena ricordare che le variazioni nella purezza e nella struttura cristallina del solfato di nichel possono influenzare leggermente il suo punto di fusione.
Densità del solfato di nichel g/mL
La densità del solfato di nichel si riferisce alla sua massa per unità di volume. La densità del solfato di nichel è generalmente di circa 3,68 grammi per millilitro (g/mL). Va notato che la densità può variare a seconda della temperatura e della purezza del campione.
Peso molecolare del solfato di nichel
Il peso molecolare del solfato di nichel (NiSO4) è la somma dei pesi atomici dei suoi elementi costitutivi. Come accennato in precedenza, il peso molecolare del solfato di nichel è di circa 154,76 grammi per mole.
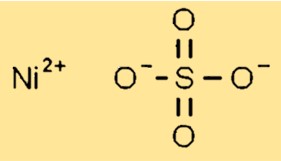
Struttura del solfato di nichel
Il solfato di nichel ha una struttura cristallina allo stato solido. Forma cristalli monoclini con ciascuno ione nichel (Ni2+) circondato da sei atomi di ossigeno provenienti da gruppi solfato. I gruppi solfato sono disposti in modo tale da consentire un’efficace compattazione del reticolo cristallino.
Solubilità del solfato di nichel
Il solfato di nichel ha una moderata solubilità in acqua. Si dissolve facilmente in acqua e la sua solubilità aumenta all’aumentare della temperatura. La presenza di altri ioni e sostanze può influenzarne la solubilità. Inoltre, il solfato di nichel può formare idrati se combinato con molecole d’acqua, portando alla formazione di vari solfati di nichel idrati.
| Aspetto | Cristalli blu/verdi |
| Peso specifico | 3,68 g/ml |
| Colore | Blu verde |
| Odore | Inodore |
| Massa molare | 154,76 g/mole |
| Densità | 3,68 g/ml |
| Punto di fusione | 100°C (212°F) |
| Punto di ebollizione | Decomposto |
| Punto flash | Non applicabile |
| solubilità in acqua | Molto solubile |
| Solubilità | Solubile in acqua e solventi organici come l’etanolo |
| Pressione del vapore | Non applicabile |
| Densità del vapore | Non applicabile |
| pKa | -1,1 (acido solforico) |
| pH | Acido (circa 4) |
Sicurezza e pericoli del solfato di nichel
Il solfato di nichel presenta alcuni rischi per la sicurezza che devono essere considerati. È essenziale maneggiarlo con cura per evitare potenziali rischi. Il contatto diretto con la pelle deve essere ridotto al minimo poiché potrebbe causare irritazione o sensibilizzazione della pelle. L’ingestione o l’inalazione di solfato di nichel dovrebbe essere evitata poiché potrebbe causare effetti negativi sulla salute. Quando si lavora con solfato di nichel, è necessario indossare dispositivi di protezione individuale adeguati, come guanti e occhiali protettivi, per evitare il contatto con la sostanza. Il solfato di nichel deve essere conservato in un luogo fresco e asciutto, lontano da materiali incompatibili. Quando si lavora con solfato di nichel è necessaria una ventilazione adeguata per ridurre al minimo la concentrazione di particelle sospese nell’aria.
| Simboli di pericolo | Nessuno |
| Descrizione della sicurezza | – Evitare il contatto con la pelle – Evitare l’ingestione e l’inalazione – Indossare adeguati dispositivi di protezione individuale |
| Identificatori delle Nazioni Unite | Non applicabile |
| Codice SA | 2833.25 |
| Classe di pericolo | Non classificato |
| Gruppo di imballaggio | Non applicabile |
| Tossicità | Può causare irritazione o sensibilizzazione alla pelle |
Metodi di sintesi del solfato di nichel
Esistono diversi metodi per sintetizzare il solfato di nichel.
Un approccio comune prevede la reazione tra nichel metallico o ossido di nichel con acido solforico . In questo metodo, l’acido solforico dissolve il Ni metallico o l’ossido di nichel, determinando la formazione di solfato di nichel. È possibile eseguire la reazione in condizioni controllate, come temperatura e agitazione, per garantire una conversione efficiente.
Un altro metodo prevede la reazione dell’acido solforico con il carbonato di nichel. L’acido solforico dissolve il carbonato di nichel, producendo solfato di nichel. I chimici in genere utilizzano questo metodo quando hanno carbonato di nichel facilmente disponibile, poiché fornisce un materiale di partenza conveniente.
Inoltre, l’acido solforico può dissolvere l’idrossido di nichel per sintetizzare NiSO4. La dissoluzione dell’idrossido di nichel nell’acido solforico porta alla formazione di NiSO4. Questo metodo è adatto quando si vuole utilizzare l’idrossido di nichel come precursore per la sintesi del solfato di nichel.
È importante notare che è necessario seguire le opportune precauzioni di sicurezza durante il processo di sintesi. Ciò include l’uso di dispositivi di protezione e procedure di manipolazione adeguati. Effettuare le reazioni in un’area ben ventilata per ridurre al minimo il rischio di esposizione a vapori nocivi. Un attento controllo dei parametri di reazione, come temperatura e concentrazione, è fondamentale per garantire una conversione e una resa ottimali del solfato di nichel.
Usi del solfato di nichel
Il solfato di nichel ha varie applicazioni in diversi settori. Ecco alcuni dei suoi usi comuni:
- Galvanotecnica: i processi di galvanostegia fanno ampio uso di solfato di nichel per creare un rivestimento durevole e resistente alla corrosione sulle superfici metalliche. Il solfato di nichel migliora l’aspetto, la durezza e la resistenza di oggetti come gioielli, ricambi auto e utensili da cucina.
- Catalizzatore: il solfato di nichel agisce come catalizzatore in molte reazioni chimiche, compresi i processi di idrogenazione e ossidazione. Le industrie utilizzano catalizzatori di solfato di nichel nella produzione di prodotti farmaceutici, petrolchimici e di chimica fine.
- Batterie: le batterie ricaricabili, in particolare le batterie Ni-Cd e Ni-MH, contengono solfato di nichel come componente essenziale. Il solfato di nichel facilita le reazioni degli elettrodi e garantisce un efficiente stoccaggio e rilascio di energia elettrica.
- Fertilizzante: alcuni fertilizzanti utilizzano Ni solubile proveniente dal solfato di nichel per fornire alle piante nutrienti essenziali. Il nichel svolge un ruolo cruciale in vari processi metabolici nelle piante, contribuendo alla loro crescita e al loro sviluppo.
- Tessili: l’industria tessile utilizza il solfato di nichel nei processi di tintura e stampa per migliorare la solidità del colore e l’assorbimento del colorante dei tessuti. Il solfato di nichel garantisce risultati cromatici vivaci e duraturi.
- Prodotti farmaceutici: il solfato di nichel trova applicazioni nelle preparazioni farmaceutiche, principalmente per produrre farmaci contenenti Ni come principio attivo o per formulare specifici complessi di Ni utilizzati nella ricerca medica.
- Ricerca e sviluppo: i laboratori utilizzano il solfato di nichel per una varietà di scopi di ricerca e sviluppo, tra cui sintesi chimica, studi elettrochimici e ricerca sulla scienza dei materiali.
Domande:
D: Qual è la formula del solfato di nichel (II)?
R: La formula per il solfato di nichel (II) è NiSO4.
D: Il cromo metallico viene aggiunto a una soluzione di solfato di nichel (II). Qual è la reazione chimica equilibrata?
R: La reazione chimica bilanciata è: Cr + NiSO4 -> CrSO4 + Ni.
D: Come produrre il solfato di nichel e ammonio?
R: Il solfato di nichel ammonio può essere preparato sciogliendo il solfato di nichel e il solfato di ammonio in acqua, seguito dalla cristallizzazione.
D: Il solfato di nichel è solubile in acqua?
R: Sì, il solfato di nichel è solubile in acqua.
D: Chi estrae il solfato di nichel?
R: Il solfato di nichel non viene estratto direttamente. I minerali di nichel vengono estratti e da questi è possibile produrre solfato di nichel.
D: Qual è il nome del composto NiSO4?
R: Il composto NiSO4 è chiamato solfato di nichel.
D: Quanti grammi di NiSO4 ci sono in 100 g di idrato? Quanti nei?
R: La quantità di NiSO4 in 100 g di idrato dipende dallo specifico composto idrato e dalla sua massa molare.
D: NiSO4 è solubile in acqua?
R: Sì, NiSO4 è solubile in acqua.
D: Quanti grammi di NiSO4 si ottengono se la resa è del 76,9%?
R: I grammi di NiSO4 ottenuti dipendono dalla quantità iniziale e dalle condizioni di reazione.
D: NiSO4 è pericoloso?
R: NiSO4 può essere pericoloso se non maneggiato correttamente. È importante seguire le istruzioni di sicurezza quando si lavora con esso.
D: Qual è il nome del composto covalente NiSO4?
R: NiSO4 non è un composto covalente. È un composto ionico chiamato solfato di nichel.
D: NiSO4 è un sale?
R: Sì, NiSO4 è considerato un sale per la sua natura ionica e per la sua formazione dalla reazione tra un acido (acido solforico) e una base (idrossido di nichel).
D: Qual è la carica di NiSO4?
R: Nel NiSO4, lo ione nichel (Ni2+) porta una carica positiva di 2+, mentre lo ione solfato (SO4 2-) porta una carica negativa di 2-.
