Il nitrato di zinco (Zn(NO3)2) è un composto contenente ioni zinco e nitrato. È solubile in acqua e comunemente utilizzato nelle industrie per varie applicazioni, anche come catalizzatore e nella produzione di coloranti e pigmenti.
| Nome IUPAC | Nitrato di zinco |
| Formula molecolare | Zn(NO3)2 |
| numero CAS | 7779-88-6 |
| Sinonimi | Dinitrato di zinco, sale di zinco dell’acido nitrico, cellossano, nitrato di zinco |
| InChI | InChI=1S/2NO3.Zn/c2 2-1(3)4;/q2 -1;+2 |
Proprietà del nitrato di zinco
Formula di nitrato di zinco
La formula del dinitrato di zinco è Zn(NO3)2. È costituito da uno ione zinco (Zn2+) e due ioni NO3- tenuti insieme da legami ionici. La formula rappresenta il rapporto tra gli elementi presenti nel composto.
Massa molare del nitrato di zinco
La massa molare del dinitrato di zinco può essere calcolata sommando le masse atomiche dei suoi elementi costitutivi. La massa atomica dello zinco (Zn) è di circa 65,38 grammi per mole, e la massa atomica di azoto (N) e ossigeno (O) negli ioni NO3 è rispettivamente di circa 14,01 e 16,00 grammi per mole. Pertanto, la massa molare del dinitrato di zinco è di circa 189,38 grammi per mole.
Punto di ebollizione del nitrato di zinco
Il dinitrato di zinco non ha un punto di ebollizione specifico poiché si decompone prima di raggiungere il punto di ebollizione. Tuttavia, quando riscaldato, si decompone in ossido di zinco, biossido di azoto e ossigeno. Questa reazione di decomposizione avviene intorno ai 140°C (284°F), rilasciando fumi marroni di biossido di azoto.
Punto di fusione del nitrato di zinco
Il punto di fusione del dinitrato di zinco dipende dal suo stato di idratazione. La forma anidra del dinitrato di zinco (Zn(NO3)2) fonde a circa 238°C (460°F). Tuttavia, la forma esaidrata (Zn(NO3)2·6H2O) ha un punto di fusione inferiore di circa 36°C (97°F) perché contiene molecole d’acqua nella sua struttura cristallina.
Densità del nitrato di zinco g/mL
La densità del dinitrato di zinco varia a seconda della sua concentrazione e temperatura. Tuttavia, in condizioni standard, la densità della forma anidra è di circa 2,065 grammi per millilitro (g/mL). La densità della forma esaidrata è leggermente superiore a causa della presenza di molecole d’acqua.
Peso molecolare del nitrato di zinco
Il peso molecolare del dinitrato di zinco si calcola sommando le masse atomiche dei suoi elementi costitutivi. Il peso molecolare del dinitrato di zinco è di circa 189,38 grammi per mole, come menzionato in precedenza.
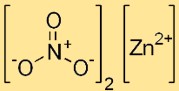
Struttura del nitrato di zinco
Il dinitrato di zinco ha una struttura ionica, con il catione zinco (Zn2+) circondato da sei molecole d’acqua in forma esaidrata. Gli ioni nitrato (NO3-) sono presenti come entità discrete nel reticolo cristallino.
Solubilità del nitrato di zinco
Il dinitrato di zinco è molto solubile in acqua. La solubilità aumenta con la temperatura. A temperatura ambiente, circa 118 grammi di dinitrato di zinco possono dissolversi in 100 grammi di acqua, ottenendo una soluzione satura.
| Aspetto | Cristalli incolori |
| Peso specifico | 2.065 g/ml |
| Colore | Incolore |
| Odore | Inodore |
| Massa molare | 189,38 g/mole |
| Densità | 2.065 g/ml |
| Punto di fusione | 238°C (460°F) (anidro) |
| Punto di ebollizione | Si decompone (~140°C/284°F) |
| Punto flash | Non applicabile |
| solubilità in acqua | Molto solubile in acqua |
| Solubilità | Solubile in acqua |
| Pressione del vapore | Non disponibile |
| Densità del vapore | Non disponibile |
| pKa | Non applicabile |
| pH | ~4 (soluzione acquosa) |
Sicurezza e pericoli del nitrato di zinco
Il dinitrato di zinco presenta alcuni rischi per la sicurezza che devono essere considerati. È importante maneggiarlo con cura per prevenire potenziali rischi. Il contatto con il composto può causare irritazione alla pelle e agli occhi. L’ingestione o l’inalazione di dinitrato di zinco può causare disturbi gastrointestinali e difficoltà respiratorie. Si consiglia di utilizzare misure protettive adeguate, come guanti e occhiali protettivi, quando si lavora con il dinitrato di zinco. Inoltre, deve essere conservato in un’area ben ventilata, lontano da sostanze incompatibili. In caso di esposizione o ingestione accidentale si consiglia di consultare un medico. Il rispetto di protocolli di sicurezza adeguati garantisce la manipolazione e l’uso sicuri del dinitrato di zinco.
| Simboli di pericolo | Agente ossidante |
| Descrizione della sicurezza | Provoca irritazione alla pelle e agli occhi. Evitare l’ingestione e l’inalazione. Manipolare con adeguate misure protettive. |
| Numeri di identificazione delle Nazioni Unite | N. ONU 1514 (anidro), N. ONU 1515 (esaidrato) |
| Codice SA | 28342990 |
| Classe di pericolo | 5.1 (Sostanze ossidanti) |
| Gruppo di imballaggio | II (anidro), III (esaidrato) |
| Tossicità | Moderatamente tossico |
Metodi di sintesi del nitrato di zinco
Esistono diversi metodi per sintetizzare il dinitrato di zinco. Un approccio comune è la reazione tra zinco metallico e acido nitrico . In questo metodo, lo zinco reagisce con l’acido nitrico per produrre dinitrato di zinco e rilasciare gas idrogeno. Gli operatori controllano attentamente la reazione per mantenere la sicurezza.
Un altro metodo prevede la reazione tra ossido di zinco e acido nitrico . L’ossido di zinco viene disciolto nell’acido nitrico, portando alla formazione di dinitrato di zinco e acqua. Questo metodo è utile quando l’ossido di zinco è facilmente disponibile.
Inoltre, il carbonato di zinco può reagire con l’acido nitrico per produrre dinitrato di zinco. Il carbonato reagisce con l’acido nitrico formando anidride carbonica, acqua e dinitrato di zinco.
È importante notare che queste reazioni devono essere effettuate in condizioni di laboratorio adeguate con le necessarie precauzioni di sicurezza. È necessario indossare dispositivi di protezione adeguati, come guanti e occhiali protettivi, e le reazioni devono essere eseguite in un’area ben ventilata.
Nel complesso, questi metodi forniscono modi efficienti per sintetizzare il dinitrato di zinco, consentendone l’uso in varie applicazioni industriali.
Usi del nitrato di zinco
Il dinitrato di zinco trova applicazioni in vari settori grazie alle sue proprietà versatili. Ecco alcuni usi chiave del dinitrato di zinco:
- Catalizzatore: il dinitrato di zinco catalizza varie reazioni chimiche, facilitando la produzione di coloranti, prodotti farmaceutici e polimeri.
- Galvanotecnica: nei processi di galvanica, il dinitrato di zinco deposita uno strato di zinco sulle superfici metalliche, conferendo resistenza alla corrosione e migliorando l’aspetto.
- Pigmenti e coloranti: il dinitrato di zinco agisce come precursore nella produzione di pigmenti e coloranti a base di zinco, essenziali per vernici, rivestimenti e tessuti.
- Fertilizzante: il dinitrato di zinco funge da fonte di zinco nei fertilizzanti, garantendo che le piante ricevano nutrienti sufficienti per la crescita e lo sviluppo.
- Produzione del vetro: il dinitrato di zinco svolge un ruolo determinante nella produzione del vetro, migliorando le proprietà ottiche come la trasparenza e l’indice di rifrazione.
- Trattamento dell’acqua: il dinitrato di zinco svolge un ruolo essenziale nei sistemi di trattamento dell’acqua, controllando la crescita di alghe e batteri e mantenendo la qualità dell’acqua.
- Reagente di laboratorio: in vari esperimenti di laboratorio, il dinitrato di zinco funziona attivamente come reagente, soprattutto nella chimica analitica e nella ricerca.
- Medicina e prodotti farmaceutici: il dinitrato di zinco contribuisce attivamente ad alcune formulazioni farmaceutiche e farmaci topici grazie alle sue proprietà antimicrobiche.
- Ritardanti di fiamma: il dinitrato di zinco è un componente chiave delle formulazioni ritardanti di fiamma, poiché riduce attivamente l’infiammabilità dei materiali.
- Industria tessile: nei processi di tintura e stampa dei tessuti, il dinitrato di zinco migliora attivamente la solidità del colore e migliora l’assorbimento del colorante.
Queste diverse applicazioni evidenziano l’importanza del dinitrato di zinco in molteplici settori, contribuendo a una gamma di prodotti e processi.
Domande:
D: Il nitrato di zinco è solubile?
R: Sì, il dinitrato di zinco è solubile in acqua.
D: Come precipitare il carbonato di zinco dal nitrato di zinco?
R: Per far precipitare il carbonato di zinco da Zn(NO3)2, aggiungere una soluzione di carbonato di sodio o bicarbonato di sodio alla soluzione di dinitrato di zinco, con conseguente formazione di carbonato di zinco come precipitato.
D: Lo zinco reagisce con il nitrato d’argento?
R: Sì, lo Zn reagisce con il nitrato d’argento, spostando l’argento metallico e formando dinitrato di zinco.
D: Il nitrato di zinco è un sale?
R: Sì, il nitrato di zinco è un sale composto da cationi zinco (Zn2+) e ioni NO3-.
D: Cosa si forma quando il nitrato di zinco reagisce con l’idrossido di potassio?
R: Quando Zn(NO3)2 reagisce con l’idrossido di potassio, Zn(OH)2 precipita e si forma nitrato di potassio.
D: Qual è la formula del nitrato di litio e zinco?
R: La formula del dinitrato di litio e zinco è LiZn(NO3)3.
D: Come standardizzare la soluzione di nitrato di magnesio e nitrato di zinco?
R: Per standardizzare le soluzioni di nitrato di magnesio e dinitrato di zinco, è possibile utilizzare metodi di titolazione con un reagente standardizzato appropriato.
D: Quali sono l’acido e l’ossido metallico utilizzati per produrre il nitrato di zinco?
R: L’acido nitrico (HNO3) e l’ossido di zinco (ZnO) vengono utilizzati per produrre il dinitrato di zinco.
D: Quali prodotti si ottengono quando lo zinco viene aggiunto a una soluzione di nitrato di piombo?
R: Quando si aggiunge Zn a una soluzione di nitrato di piombo, si formano dinitrato di zinco e piombo metallico.
D: Cos’è il nitrato di zinco?
R: Il dinitrato di zinco è un composto chimico composto da cationi di zinco (Zn2+) e anioni NO3-, spesso presenti come solido cristallino.
D: Quanti atomi di ossigeno ci sono in 1,50 moli di Zn(NO3)2?
R: In 1,50 moli di Zn(NO3)2 ci sono 9,00 moli o 27,00 atomi di ossigeno.
D: Quale massa di Zn(NO3)2 deve essere diluita fino a raggiungere una massa di 1,00 kg con H2O per preparare 97 ppm di Zn2+(aq)?
R: Per preparare una soluzione contenente 97 ppm di Zn2+(aq), circa 97 mg di Zn(NO3)2 devono essere diluiti con acqua fino ad una massa di 1,00 kg.
