L’ammide di sodio (NaNH2) è un composto chimico. È costituito da atomi di sodio e azoto. È usato come base forte in varie reazioni chimiche.
| Nome IUPAC | Ammide di sodio |
| Formula molecolare | NaNH2 |
| numero CAS | 7782-92-5 |
| Sinonimi | Sodamide, azanide di sodio, ammide di sodio, nitruro di sodio |
| InChI | InChI=1S/NaN2/c2-1-3/q-1 |
Proprietà dell’ammide di sodio
Formula di sodio ammide
La formula dell’ammide di sodio è NaNH2. È costituito da un atomo di sodio (Na), un atomo di idrogeno (H) e un atomo di azoto (N). Questa formula chimica rappresenta la composizione dell’ammide di sodio a livello molecolare.
Massa molare dell’ammide di sodio
La massa molare dell’azanide di sodio si calcola sommando le masse atomiche dei suoi elementi costitutivi. Il sodio ha una massa atomica di 22,99 grammi per mole (g/mol) e l’azoto ha una massa atomica di 14,01 g/mol. Sommando questi valori, vediamo che la massa molare dell’azanide di sodio è di circa 39 g/mol.
Punto di ebollizione dell’ammide di sodio
Il punto di ebollizione dell’azanide di sodio è la temperatura alla quale passa dallo stato liquido a quello gassoso. L’azanide di sodio ha un punto di ebollizione relativamente alto di circa 850 gradi Celsius (°C). A questa temperatura le forze intermolecolari che tengono insieme le molecole di azanuro di sodio vengono superate, determinando la conversione dallo stato liquido a quello gassoso.
Ammide di sodio Punto di fusione
Il punto di fusione dell’azanide di sodio è la temperatura alla quale passa da solido a liquido. L’azanide di sodio ha un punto di fusione relativamente basso di circa 210 gradi Celsius (°C). A questa temperatura, la struttura del reticolo cristallino dell’azanide di sodio solido si rompe, consentendo alle particelle di muoversi liberamente, formando un liquido.
Densità dell’ammide di sodio g/mL
La densità dell’azanide di sodio è una misura della sua massa per unità di volume. La densità dell’azanide di sodio è di circa 1,39 grammi per millilitro (g/mL). Questo valore indica che l’azanide di sodio è una sostanza relativamente densa.
Peso molecolare dell’ammide di sodio
Il peso molecolare dell’azanide di sodio è la somma dei pesi atomici di tutti gli atomi nella sua formula chimica. Il peso molecolare dell’azanide di sodio è di circa 39 grammi per mole (g/mol).
Struttura dell’ammide di sodio
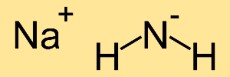
La struttura dell’azanide di sodio è costituita da un atomo di sodio (Na) legato a due atomi di azoto (N). Gli atomi di azoto formano una disposizione lineare con l’atomo di sodio al centro, risultando in una struttura molecolare lineare.
Solubilità dell’ammide di sodio
L’azanide di sodio è scarsamente solubile in acqua. Reagisce con l’acqua per formare idrossido di sodio (NaOH) e ammoniaca (NH3). Tuttavia, è solubile in alcuni solventi organici come l’ammoniaca liquida e gli alcoli liquidi. La solubilità dell’azanide di sodio in questi solventi ne consente l’utilizzo in varie reazioni chimiche.
| Aspetto | Solido bianco |
| Peso specifico | 1,39 g/ml |
| Colore | Bianco |
| Odore | Simile all’ammoniaca |
| Massa molare | 39 g/mole |
| Densità | 1,39 g/ml |
| Punto di fusione | 210°C |
| Punto di ebollizione | 850°C |
| Punto flash | Non applicabile |
| solubilità in acqua | Reagisce |
| Solubilità | Solubile in solventi organici come ammoniaca liquida e alcoli liquidi |
| Pressione del vapore | Non applicabile |
| Densità del vapore | Non applicabile |
| pKa | Non applicabile |
| pH | Alcalina (sopra 7) |
Sicurezza e pericoli dell’ammide di sodio
L’azanide di sodio pone alcuni rischi e pericoli per la sicurezza che devono essere considerati. Reagisce violentemente con l’acqua, rilasciando gas tossico di ammoniaca e idrossido di sodio corrosivo. Deve quindi essere maneggiato con estrema cautela per evitare il contatto con umidità o acqua. Anche l’azanide di sodio è una base forte, che può causare gravi ustioni e danni agli occhi se entra in contatto con la pelle o gli occhi. L’inalazione delle sue polveri o vapori può irritare il sistema respiratorio. Si consiglia di indossare dispositivi di protezione adeguati, come guanti, occhiali e un respiratore, quando si lavora con azanide di sodio. Una ventilazione adeguata e lo stoccaggio lontano da sostanze incompatibili sono misure di sicurezza essenziali.
| Simboli di pericolo | Corrosivo, Nocivo, Tossico |
| Descrizione della sicurezza | Maneggiare con estrema cautela. Evitare il contatto con acqua/umidità. Indossare dispositivi di protezione. Sono necessarie ventilazione e stoccaggio adeguati. |
| Numeri di identificazione delle Nazioni Unite | ONU 1410 |
| Codice SA | 28500020 |
| Classe di pericolo | 4.3 (Pericoloso se bagnato), 6.1 (Tossico), 8 (Corrosivo) |
| Gruppo di imballaggio | II |
| Tossicità | Tossico per ingestione, inalazione o contatto con la pelle/occhi |
Metodi per la sintesi della sodio ammide
Esistono vari metodi per sintetizzare l’azanide di sodio.
Un metodo comune è la reazione tra sodio metallico e ammoniaca gassosa (NH3) . In questo processo, il sodio metallico reagisce con il gas di ammoniaca in condizioni controllate per produrre azanide di sodio. La reazione avviene solitamente in un reattore dotato di adeguate misure di sicurezza.
Un altro metodo prevede la reazione tra idruro di sodio (NaH) e gas di ammoniaca . L’idruro di sodio, un composto solido, reagisce con il gas di ammoniaca per produrre azanuro di sodio e gas idrogeno. Per eseguire questa reazione vengono spesso utilizzate atmosfere inerti per evitare reazioni collaterali indesiderate.
Inoltre, la reazione tra sodio metallico e ammoniaca liquida consente la preparazione dell’azanide di sodio. Questo metodo prevede la dissoluzione del sodio metallico nell’ammoniaca liquida, con conseguente formazione di azanuro di sodio e gas idrogeno.
Per sintetizzare l’azanide di sodio, la sodio azide (NaN3) reagisce con l’idrossido di sodio (NaOH). La reazione tra questi due composti produce azanuro di sodio e il rilascio di gas azoto.
Va notato che questi metodi sintetici richiedono esperienza e adeguate precauzioni di sicurezza a causa della reattività e dei rischi associati all’azanide di sodio.
Usi dell’ammide di sodio
L’azanuro di sodio trova applicazioni in vari campi grazie alle sue proprietà uniche. Ecco alcuni dei suoi usi:
- Base forte nelle reazioni di chimica organica: l’azanide di sodio deprotona gli acidi deboli, facilitando la sintesi di vari composti organici.
- Fonte di azoto nelle reazioni: l’azanide di sodio introduce atomi di azoto nelle molecole organiche, svolgendo un ruolo cruciale nella sintesi di prodotti farmaceutici, coloranti e polimeri.
- Deidroalogenazione: L’azanuro di sodio rimuove gli alogenuri di idrogeno dai composti organici nelle reazioni di deidroalogenazione. Questo processo facilita la preparazione di alcheni, alchini e altri composti insaturi.
- Reazioni di apertura dell’anello: l’azanide di sodio partecipa alle reazioni di apertura dell’anello di composti ciclici, come la sintesi di Gabriel, convertendo le ammine cicliche in ammine primarie.
- Desolforazione: l’azanide di sodio può rimuovere gli atomi di zolfo dai composti organici, consentendo reazioni di desolforazione. Ciò è utile nella produzione di combustibili senza zolfo e nella riduzione dell’impatto ambientale dei composti contenenti zolfo.
- Stoccaggio dell’idrogeno: i ricercatori hanno studiato il potenziale utilizzo dell’azanide di sodio nei sistemi di stoccaggio dell’idrogeno. Può reagire con l’idrogeno gassoso, formando idruro di sodio, che può quindi rilasciare idrogeno durante il riscaldamento.
- Supporto catalitico: l’azanide di sodio può agire come supporto catalitico, migliorando le prestazioni di alcune reazioni catalitiche. Garantisce la stabilità e migliora l’efficienza dei catalizzatori in varie trasformazioni chimiche.
Nel complesso, le proprietà versatili dell’azanide di sodio lo rendono un composto prezioso nella sintesi organica, nella chimica dell’azoto e in altre applicazioni industriali.
Domande:
D: Cosa fa NaNH2?
R: NaNH2 è una base forte comunemente utilizzata nelle reazioni di chimica organica per deprotonare gli acidi deboli e facilitare varie trasformazioni.
D: Cos’è NaNH2?
R: NaNH2 è sodio ammide, un composto chimico costituito da ioni sodio (Na) e azanide (NH2), spesso utilizzato come reagente e base forte nella sintesi organica.
D: A cosa serve l’eccesso di NaNH2?
R: Un eccesso di NaNH2 può portare a un’ulteriore deprotonazione degli atomi di idrogeno acido in una reazione, aumentando così l’entità della deprotonazione e modificando potenzialmente l’esito della reazione.
D: Cosa fa NaNH2 a un alchene?
R: NaNH2 può estrarre un atomo di idrogeno da un alchene, dando luogo alla formazione di un alcano e di un composto di alcossido di sodio.
D: Cosa fa NaNH2 al bromobenzene?
R: NaNH2 può sostituire l’atomo di bromo nel bromobenzene attraverso una reazione di sostituzione nucleofila, che porta alla formazione di fenilammina sodica.
D: NaNH2 è una base forte?
R: Sì, NaNH2 è una base forte in grado di accettare protoni e deprotonare acidi deboli grazie alla presenza dello ione ammide.
D: Quale reazione avrà luogo se si aggiunge H2O a una miscela NaNH2/NH3?
R: L’aggiunta di H2O a una miscela NaNH2/NH3 provoca la generazione di gas di ammoniaca (NH3) e idrossido di sodio (NaOH) a causa della reazione tra acqua e la base forte NaNH2.
D: Quale intermedio è coinvolto in questa reazione: NaNH2 + NH3 liquido?
R: L’intermedio coinvolto nella reazione di NaNH2 con NH3 liquida è un elettrone solvatato, formato dalla donazione di un elettrone dal sodio all’ammoniaca.
D: NaNH2 è un buon nucleofilo?
R: Sì, NaNH2 può agire come un buon nucleofilo grazie alla sua capacità di donare una coppia di elettroni e partecipare alle reazioni di sostituzione nucleofila.
D: NaNH2 è ionico o covalente?
R: NaNH2 è un composto ionico composto da ioni sodio caricati positivamente (Na+) e ioni ammide caricati negativamente (NH2-).
D: Il 2-esine reagirà con l’ammide di sodio?
R: Sì, il 2-esine può reagire con l’ammide di sodio, dando luogo alla formazione di acetiluro di sodio e del corrispondente composto alchino.
D: Qual è la base più forte tra l’ammide di sodio e il fenossato di sodio?
R: L’azanide di sodio è la base più forte del fenoxato di sodio a causa della maggiore basicità dello ione ammide (NH2-) rispetto allo ione fenossido (C6H5O-).
