L’ossicloruro di fosforo (POCl3) è un composto chimico utilizzato in vari processi industriali. Reagisce con l’acqua per formare acido fosforico e acido cloridrico.
| Nome IUPAC | Ossicloruro di fosforo |
| Formula molecolare | POCl3 |
| numero CAS | 10025-87-3 |
| Sinonimi | Cloruro di fosforile, tricloruro di fosforile, tricloruro di fosforo |
| InChI | InChI=1S/Cl3OP/c1-4(2)3 |
Proprietà dell’ossicloruro di fosforo
Formula di ossicloruro di fosforo
La formula chimica del cloruro di fosforile è POCl3. È composto da un atomo di fosforo (P), simboleggiato da P, e tre atomi di cloro (Cl), simboleggiato da Cl. La formula indica il rapporto di ciascun elemento presente nel composto.
Massa molare dell’ossicloruro di fosforo
La massa molare del cloruro di fosforile può essere calcolata sommando le masse atomiche dei suoi elementi costitutivi. Il fosforo ha una massa molare di 30,97 g/mol, mentre il cloro ha una massa molare di 35,45 g/mol. Moltiplicando la massa molare del cloro per 3 e aggiungendo la massa molare del fosforo si ottiene una massa molare totale di circa 153,33 g/mol per il cloruro di fosforile.
Punto di ebollizione dell’ossicloruro di fosforo
Il cloruro di fosforil ha un punto di ebollizione di circa 105,5°C. Questa temperatura rappresenta il punto in cui il composto liquido passa allo stato gassoso sotto la pressione atmosferica standard. Il punto di ebollizione è una caratteristica importante che influenza la manipolazione e l’applicazione del cloruro di fosforile.
Ossicloruro di fosforo Punto di fusione
Il punto di fusione del cloruro di fosforile è di circa -112,5°C. Ciò significa la temperatura alla quale il composto solido passa allo stato liquido. Il punto di fusione è un parametro critico per le considerazioni sullo stoccaggio e sul trasporto.
Densità dell’ossicloruro di fosforo g/mL
La densità del cloruro di fosforile è di circa 1,65 g/mL. La densità si riferisce alla quantità di massa per unità di volume di una sostanza. Una densità maggiore suggerisce una maggiore concentrazione di particelle in un dato volume.
Peso molecolare dell’ossicloruro di fosforo
Il peso molecolare del cloruro di fosforile viene calcolato sommando le masse atomiche dei suoi elementi costitutivi. Il peso molecolare del fosforo è di circa 30,97 g/mol, mentre il cloro ha un peso molecolare di 35,45 g/mol. L’aggiunta delle masse ponderate fornisce un peso molecolare approssimativo di 153,33 g/mol per il cloruro di fosforile.
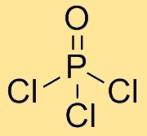
Struttura dell’ossicloruro di fosforo
Il cloruro di fosforile ha una struttura molecolare in cui un atomo di fosforo è legato a tre atomi di cloro e un atomo di ossigeno. Gli atomi di cloro sono disposti simmetricamente attorno all’atomo centrale di fosforo, con l’atomo di ossigeno legato anche all’atomo di fosforo. Questa disposizione forma una geometria tetraedrica.
Solubilità dell’ossicloruro di fosforo
Il cloruro di fosforile è scarsamente solubile in acqua ma si dissolve facilmente in solventi organici come benzene, tetracloruro di carbonio e cloroformio. Il suo comportamento di solubilità è attribuito alla natura polare della molecola e alla presenza di atomi elettronegativi come ossigeno e cloro.
| Aspetto | Liquido incolore |
| Peso specifico | 1.645 g/ml |
| Colore | Incolore |
| Odore | Acri |
| Massa molare | 153,33 g/mole |
| Densità | 1.645 g/ml |
| Punto di fusione | -112,5°C |
| Punto di ebollizione | 105,5°C |
| Punto flash | Non applicabile |
| solubilità in acqua | Reagisce vigorosamente |
| Solubilità | Solubile in solventi organici come benzene, tetracloruro di carbonio e cloroformio |
| Pressione del vapore | 11 mmHg a 20°C |
| Densità del vapore | 5.29 (Aria = 1) |
| pKa | Non applicabile |
| pH | Non applicabile |
Sicurezza e pericoli dell’ossicloruro di fosforo
Il cloruro di fosforil presenta rischi per la sicurezza e richiede un’attenta manipolazione. È corrosivo per la pelle, gli occhi e il sistema respiratorio. Il contatto può causare gravi ustioni e danni agli occhi. L’inalazione dei suoi fumi o vapori può irritare le vie respiratorie. Quando si lavora con questo composto è necessario indossare dispositivi di protezione individuale adeguati, come guanti e occhiali protettivi. Dovrebbe essere conservato in un’area ben ventilata, lontano da fonti di ignizione. In caso di esposizione è necessaria l’immediata assistenza medica. Inoltre, deve essere maneggiato sotto una cappa aspirante per evitare il rilascio di vapori tossici.
| Simboli di pericolo | Corrosivo, Pericolo |
| Descrizione della sicurezza | Corrosivo. Provoca gravi ustioni cutanee e lesioni oculari. Può essere nocivo se inalato o ingerito. Evitare il contatto e l’inalazione. |
| Numeri di identificazione delle Nazioni Unite | Un 1810 |
| Codice SA | 2812.10.00 |
| Classe di pericolo | Classe 8 (materie corrosive) |
| Gruppo di imballaggio | Gruppo di imballaggio III (rischio minore) |
| Tossicità | Il cloruro di fosforil è tossico e può causare gravi effetti sulla salute. |
Metodi per la sintesi dell’ossicloruro di fosforo
Il cloruro di fosforil può essere sintetizzato con vari metodi. Un metodo comune prevede la reazione tra tricloruro di fosforo (PCl3) e ossigeno (O2). In questo processo, PCl3 viene riscaldato in presenza di ossigeno in eccesso per formare cloruro di fosforile. La reazione è esotermica e solitamente avviene in un ambiente controllato, come il recipiente di un reattore.
Un altro metodo di sintesi prevede la reazione tra anidride fosforica (P2O5) e tricloruro di fosforo. P2O5 agisce come agente disidratante e, quando combinato con PCl3 , forma cloruro di fosforile.
Inoltre, il cloruro di fosforile può essere sintetizzato mediante la reazione del tribromuro di fosforo (PBr3) e del pentossido di fosforo. Questa reazione porta alla formazione di cloruro di fosforile e pentabromuro di fosforo.
Inoltre, la clorazione diretta del fosforo può anche produrre cloruro di fosforile. In questo processo, il cloro gassoso passa sul fosforo riscaldato, provocando la formazione di cloruro di fosforile.
È importante notare che questi metodi sintetici devono essere eseguiti con cautela a causa della reattività e della natura pericolosa dei composti coinvolti. È necessario seguire protocolli di sicurezza adeguati, compreso l’uso di dispositivi di protezione e condizioni di reazione controllate, per garantire la manipolazione e la sintesi sicure del cloruro di fosforile.
Usi dell’ossicloruro di fosforo
Il cloruro di fosforil trova varie applicazioni in diversi settori grazie alle sue proprietà uniche. Ecco alcuni usi comuni:
- Sintesi chimica: la chimica organica utilizza ampiamente il cloruro di fosforile come reagente versatile per produrre vari composti, inclusi acidi fosfonici, esteri e ammidi.
- Prodotti chimici per l’agricoltura: la sintesi di pesticidi ed erbicidi nella protezione delle colture e nel controllo dei parassiti si riferisce al cloruro di fosforile come ingrediente chiave, svolgendo un ruolo cruciale.
- Industria farmaceutica: la produzione di intermedi farmaceutici e ingredienti farmaceutici attivi (API) utilizza cloruro di fosforile, facilitando la sintesi di farmaci importanti come i farmaci antimalarici e antinfiammatori.
- Industria dei polimeri: nella produzione dei polimeri, il cloruro di fosforile agisce come catalizzatore e agente clorurante, contribuendo alla sintesi di additivi ritardanti di fiamma che migliorano la resistenza al fuoco dei materiali.
- Produzione di coloranti e pigmenti: il cloruro di fosforile trova applicazione nella produzione di coloranti e pigmenti, in particolare nella preparazione di cloroalchil fosfonati, composti essenziali per lo sviluppo di coloranti utilizzati nei tessili, inchiostri e rivestimenti.
- Reagente di laboratorio: varie procedure di laboratorio utilizzano il cloruro di fosforile come reagente, inclusa la conversione di alcoli in cloruri alchilici e la preparazione di agenti fosforilanti.
- Trattamento dell’acqua: i processi di trattamento dell’acqua utilizzano il cloruro di fosforile come agente acidificante e disinfettante per controllare i livelli di pH e rimuovere le impurità.
- Ritardanti di fiamma: il cloruro di fosforile svolge un ruolo nella produzione di materiali ritardanti di fiamma, migliorando le proprietà di sicurezza antincendio di tessuti, plastica e materiali da costruzione.
Queste diverse applicazioni dimostrano l’importanza del cloruro di fosforile in molti settori industriali, evidenziando il suo ruolo cruciale nella sintesi chimica, nell’agricoltura, nella farmaceutica e nella scienza dei materiali.
Domande
D: Qual è la geometria molecolare di POCl3?
R: La geometria molecolare di POCl3 è trigonale piramidale.
D: Qual è l’alchene principale che si forma quando il composto A viene disidratato con POCl3 e piridina?
R: L’alchene principale formato durante la disidratazione del composto A con POCl3 e piridina dipende dalla struttura specifica del composto A.
D: POCl3 è polare o non polare
R: POCl3 è una molecola polare a causa della presenza di legami polari e di una forma molecolare asimmetrica.
D: Quanto gas POCl3 può essere prodotto?
R: Il volume del gas POCl3 prodotto dipende dalle quantità di reagenti e dalle condizioni specifiche di reazione.
D: Quante moli di POCl3 ci sono in 10,0 grammi di POCl3?
R: Ci sono circa 0,082 moli di POCl3 in 10,0 grammi di POCl3.
D: Qual è la geometria della coppia di elettroni per P in POCl3?
R: La geometria della coppia di elettroni per P in POCl3 è tetraedrica.
D: POCl3 ha un momento dipolare?
R: Sì, POCl3 ha un momento dipolare dovuto alla presenza di legami polari e alla sua geometria molecolare.
D: POCl3 ha risonanza?
R: No, POCl3 non presenta risonanza perché non ci sono elettroni delocalizzati o strutture di risonanza multiple.
D: Qual è la geometria del dominio elettronico attorno all’atomo di ossigeno in POCl3?
R: La geometria del dominio elettronico attorno all’atomo di ossigeno in POCl3 è piramidale trigonale.
D: Quale volume di H3PO4 si formerà quando 72,3 ml di POCl3 reagiscono completamente?
R: Il volume di H3PO4 formato quando reagiscono 72,3 ml di POCl3 dipende completamente dalla stechiometria della reazione e non può essere determinato basandosi esclusivamente sulle informazioni fornite.
