Il bicloruro di zolfo (SCl₂) è un composto chimico formato dalla combinazione di zolfo e cloro. Viene utilizzato in varie industrie per produrre coloranti, gomma e pesticidi.
| Nome IUPAC | Dicloruro di zolfo |
| Formula molecolare | SCl₂ |
| numero CAS | 10545-99-0 |
| Sinonimi | Monosolfuro di cloro, cloruro solforoso, dicloruro di zolfo, cloruro di zolfo, diclorosulfano |
| InChI | InChI=1S/Cl2S/c1-3-2 |
Proprietà del cloruro di zolfo
Formula del dicloruro di zolfo
La formula del cloruro di zolfo è SCl₂. Rappresenta la combinazione di un atomo di zolfo e due atomi di cloro. Questa formula chimica riflette accuratamente la composizione e la struttura del composto.
Massa molare del dicloruro di zolfo
La massa molare del cloruro di zolfo può essere calcolata sommando le masse atomiche dei suoi elementi costitutivi. Lo zolfo ha una massa molare di 32,06 g/mol e il cloro ha una massa molare di 35,45 g/mol. Aggiungendo le masse di due atomi di cloro e un atomo di zolfo, si determina che la massa molare del cloruro di zolfo è pari a circa 102,91 g/mol.
Punto di ebollizione del dicloruro di zolfo
Il cloruro di zolfo ha un punto di ebollizione di 138,8°C (281,8°F). Questa temperatura indica il punto in cui il composto liquido passa allo stato gassoso sotto la pressione atmosferica standard. È importante considerare il punto di ebollizione del cloruro di zolfo quando lo si maneggia o lo si utilizza in varie applicazioni.
Dicloruro di zolfo Punto di fusione
Il punto di fusione del cloruro di zolfo è -76,8°C (-106,2°F). Questa temperatura rappresenta il punto in cui il composto solido passa allo stato liquido. Conoscere il punto di fusione è essenziale quando si lavora con il cloruro di zolfo per garantire una corretta manipolazione e conservazione.
Densità del dicloruro di zolfo g/mL
Il cloruro di zolfo ha una densità di circa 1,64 g/ml. Il valore di densità indica la quantità di massa per unità di volume della sostanza. Questa proprietà è essenziale per comprendere il comportamento e le caratteristiche del cloruro di zolfo in diversi contesti, come durante le reazioni chimiche o per determinarne l’idoneità per applicazioni specifiche.
Peso molecolare del dicloruro di zolfo
Il peso molecolare del cloruro di zolfo è di circa 102,91 g/mol. Rappresenta la massa totale di una molecola del composto, calcolata sommando le masse atomiche dei suoi elementi costitutivi. Il peso molecolare fornisce preziose informazioni sulla massa del composto e consente misurazioni precise in vari calcoli chimici.
Struttura del dicloruro di zolfo
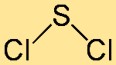
La struttura del cloruro di zolfo è meglio descritta come una molecola curva o a forma di V. È costituito da un atomo di zolfo centrale legato a due atomi di cloro. La disposizione degli atomi e i loro angoli di legame contribuiscono alla stabilità e alla reattività complessive del composto.
Solubilità del dicloruro di zolfo
Il cloruro di zolfo ha una solubilità limitata in acqua. È scarsamente solubile e tende a formare una soluzione torbida se miscelato con acqua. Le caratteristiche di solubilità del composto sono importanti da considerare quando si determina la sua compatibilità con altre sostanze e il suo comportamento in diversi solventi.
| Aspetto | Liquido giallo |
| Peso specifico | 1,64 g/ml |
| Colore | GIALLO |
| Odore | Acri |
| Massa molare | 102,91 g/mole |
| Densità | 1,64 g/ml |
| Punto di fusione | -76,8°C |
| Punto di ebollizione | 138,8°C |
| Punto flash | Non disponibile |
| solubilità in acqua | Reagisce |
| Solubilità | Solubile in acido acetico glaciale, benzene, bromo |
| Pressione del vapore | 35,4 mmHg |
| Densità del vapore | 3,9 (aria=1) |
| pKa | Non disponibile |
| pH | Non disponibile |
Sicurezza e pericoli del cloruro di zolfo
Il cloruro di zolfo presenta numerosi rischi per la sicurezza e deve essere maneggiato con cautela. È molto corrosivo e può provocare gravi ustioni a contatto con la pelle, gli occhi o le mucose. L’inalazione dei suoi vapori può irritare il sistema respiratorio e provocare tosse, difficoltà respiratorie e danni ai polmoni. È anche infiammabile e può accendersi in presenza di determinate sostanze. Quando si lavora con cloruro di zolfo, è necessario utilizzare dispositivi di protezione adeguati come guanti, occhiali e protezione respiratoria. È essenziale maneggiare e conservare questo composto in un’area ben ventilata, lontano da fonti di ignizione e materiali incompatibili, per evitare incidenti e potenziali danni.
| Simboli di pericolo | Corrosivo |
| Descrizione della sicurezza | Evitare il contatto, indossare dispositivi di protezione, lavorare in aree ben ventilate |
| Numeri di identificazione delle Nazioni Unite | Un 1828 |
| Codice SA | 2812.10.00 |
| Classe di pericolo | 8 (Sostanze corrosive) |
| Gruppo di imballaggio | II |
| Tossicità | Molto tossico |
Metodi per la sintesi del cloruro di zolfo
Esistono diversi metodi per sintetizzare il cloruro di zolfo. Un approccio comune prevede la reazione tra zolfo e cloro gassoso. In questo processo, è presente un eccesso di cloro quando si riscalda lo zolfo a una temperatura specifica, solitamente intorno ai 200-250°C (392-482°F). La reazione procede per formare cloruro di zolfo.
Un altro metodo prevede la reazione tra cloruro di tionile (SOCl₂) e zolfo. Il cloruro di tionile funge da fonte di cloro, che reagisce con lo zolfo per produrre cloruro di zolfo. Questa reazione avviene ad una temperatura relativamente più bassa rispetto al metodo diretto allo zolfo-cloro.
La reazione tra cloruro di solforile (SO₂Cl₂) e idrogeno solforato (H₂S) consente la preparazione del cloruro di zolfo. Questa reazione avviene ad alte temperature e produce cloruro di zolfo e altri sottoprodotti.
Per garantire la sicurezza del personale coinvolto, è fondamentale effettuare la sintesi del cloruro di zolfo in laboratori o ambienti industriali ben attrezzati. Il personale deve seguire adeguate precauzioni di sicurezza, compreso indossare dispositivi di protezione e lavorare in aree ben ventilate, a causa della natura pericolosa del composto.
La scelta del metodo di sintesi dipende da vari fattori, tra cui la disponibilità delle materie prime, la purezza desiderata del prodotto e i requisiti applicativi specifici. La scelta della tecnica appropriata dipende dalle esigenze specifiche del processo o dell’applicazione, poiché ciascun metodo presenta vantaggi e considerazioni specifici.
Usi del cloruro di zolfo
Il cloruro di zolfo (SCl₂) trova applicazioni in vari settori e processi grazie alle sue proprietà specifiche. Ecco alcuni usi chiave del cloruro di zolfo:
- Produzione di coloranti: i produttori utilizzano il cloruro di zolfo per produrre coloranti, in particolare coloranti allo zolfo, che conferiscono colori vivaci ai tessuti nell’industria tessile.
- Industria della gomma: l’industria della gomma utilizza SCl₂ come agente vulcanizzante per migliorare la resistenza e l’elasticità dei prodotti in gomma reticolando le catene polimeriche.
- Sintesi di pesticidi: il cloruro di zolfo svolge un ruolo cruciale nella sintesi di alcuni pesticidi, consentendo la produzione di insetticidi e fungicidi chiamati composti organofosfati e organotiofosfati.
- Sintesi chimica: SCl₂ funge da reagente versatile in varie reazioni chimiche, consentendo reazioni di clorurazione come la conversione di alcoli in cloruri alchilici o la sintesi di composti organici clorurati.
- Reagente di laboratorio: i laboratori utilizzano il cloruro di zolfo come reagente per molteplici applicazioni, tra cui sintesi organica, chimica dello zolfo e reazioni inorganiche.
- Trattamento dell’acqua: i processi di trattamento dell’acqua utilizzano SCl₂ come disinfettante e agente ossidante per rimuovere microrganismi dannosi e inquinanti organici dalle fonti d’acqua.
- Industria farmaceutica: il cloruro di zolfo trova applicazioni nella ricerca e sviluppo farmaceutico, in particolare nella sintesi di alcuni principi farmaceutici attivi (API).
- Analisi chimica: le tecniche di chimica analitica, come la gascromatografia, utilizzano SCl₂ per rilevare e analizzare composti specifici.
Queste varie applicazioni evidenziano l’importanza del cloruro di zolfo in vari processi industriali e attività scientifiche. Tuttavia, è importante maneggiare e utilizzare il cloruro di zolfo con attenzione, seguendo le linee guida e le procedure di sicurezza adeguate a causa della sua natura pericolosa.
Domande:
D: Qual è la formula del dicloruro di zolfo?
R: La formula del cloruro di zolfo è SCl₂.
D: Quale formula rappresenta il composto molecolare del cloruro di zolfo?
R: Il composto molecolare cloruro di zolfo è rappresentato dalla formula SCl₂.
D: Il bicloruro di zolfo è polare?
R: Sì, il cloruro di zolfo è polare a causa della presenza di una geometria molecolare curva e di una distribuzione non uniforme della densità elettronica.
D: Quali orbitali atomici o ibridi costituiscono il legame sigma tra S e Cl nel bicloruro di zolfo, SCl₂?
R: Il legame sigma tra lo zolfo (S) e il cloro (Cl) nel cloruro di zolfo (SCl₂) è formato dalla sovrapposizione dell’orbitale 3p dello zolfo e dell’orbitale 3p del cloro.
D: SCl₂ è lineare?
R: No, il cloruro di zolfo (SCl₂) non è lineare. Ha una geometria molecolare curva o a forma di V.
D: Quale dei seguenti è un composto ionico? Cl₂O, CH₂O, SCl₂, PF₅, Mg₃(PO₄)₂.
R: Nessuno dei composti elencati è composto ionico. Questi sono composti molecolari (Cl₂O, CH₂O, SCl₂, PF₅) o un composto fosfato inorganico (Mg₃(PO₄)₂).
D: Qual è il nome del composto con la formula SCl₂?
R: Il composto con la formula SCl₂ si chiama cloruro di zolfo.
D: Qual è la forma di SCl₂?
R: SCl₂ ha una forma molecolare curva o a forma di V.
D: Qual è la geometria molecolare di SCl₂?
R: La geometria molecolare di SCl₂ è curva o a forma di V.
D: Quali sono i nomi degli orbitali ibridi utilizzati dallo zolfo in SCl₂?
R: L’atomo di zolfo in SCl₂ utilizza orbitali ibridi sp².
D: Cosa succede quando un atomo di zolfo si combina con due atomi di cloro per produrre SCl₂?
R: Quando un atomo di zolfo si combina con due atomi di cloro, forma il composto SCl₂, noto come cloruro di zolfo. L’atomo di zolfo condivide gli elettroni con gli atomi di cloro per creare un legame covalente tra loro.
