Il 4-Etilfenolo o C8H10O è un composto chimico dall’odore dolce, speziato ed erbaceo, utilizzato nei profumi, negli aromi e come fungicida in agricoltura. Può anche essere un sottoprodotto del deterioramento del vino.
| Nome IUPAC | 4-etilfenolo |
| Formula molecolare | C8H10O |
| numero CAS | 104-96-7 |
| Sinonimi | p-etilfenolo, 4-idrossietilbenzene, 4-EHP |
| InChI | InChI=1S/C8H10O/c1-7-3-2-6-4-8(7)5-9/h2-5.9H.6H2.1H3 |
Formula 4-etilfenolo
La formula del 4-etilfenolo è C8H10O. La formula fornisce il numero e il tipo di atomi nella molecola e viene utilizzata per calcolarne la massa molare, il peso molecolare e altre proprietà.
C8H10O NMR
La spettroscopia di risonanza magnetica nucleare (NMR) consente agli scienziati di studiare la struttura e la composizione delle molecole. Analizzando lo spettro NMR C8H10O del 4-etilfenolo, possono identificare spostamenti chimici, costanti di accoppiamento e intensità di picco che rivelano informazioni sulla struttura e sulla composizione della molecola.
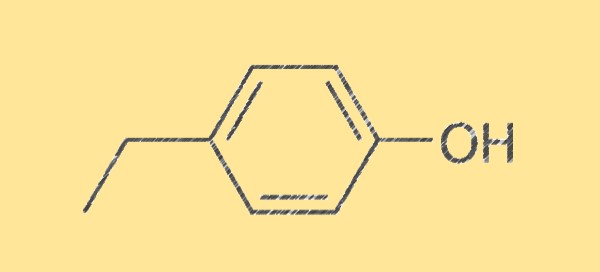
Struttura del 4-etilfenolo C8H10O
La struttura del 4-etilfenolo è caratterizzata dalla sua formula molecolare, C8H10O, composta da otto atomi di carbonio, dieci atomi di idrogeno e un atomo di ossigeno. È un liquido incolore con odore dolce, speziato ed erbaceo. La molecola è simmetrica e ha un gruppo ossidrile (-OH) attaccato a un atomo di carbonio, rendendola un fenolo.
Massa molare del 4-etilfenolo
La massa molare del 4-etilfenolo è 134,17 g/mol. La massa molare è definita come la massa di una sostanza contenente una mole di entità, come atomi, molecole o ioni. Si calcola sommando le masse atomiche di tutti gli elementi della molecola. Nel caso del 4-etilfenolo, la sua formula molecolare (C8H10O) ci dà la massa molare di 134,17 g/mol.
Punto di ebollizione del 4-etilfenolo
Il punto di ebollizione del 4-etilfenolo è 218,7°C. Il punto di ebollizione di una sostanza è la temperatura alla quale la sua pressione di vapore eguaglia la pressione atmosferica e il liquido si trasforma in vapore. Il punto di ebollizione del 4-etilfenolo è relativamente alto a causa delle forze di attrazione intermolecolari presenti nella molecola.
Punto di fusione del 4-etilfenolo
Il punto di fusione del 4-etilfenolo è 9,7°C. Il punto di fusione di una sostanza è la temperatura alla quale essa passa dallo stato solido a quello liquido. Il punto di fusione del 4-etilfenolo è relativamente basso a causa del suo basso peso molecolare e della mancanza di forti forze intermolecolari.
Densità del 4-etilfenolo g/ml
La densità del 4-etilfenolo è 1,02 g/mL. La densità di una sostanza è definita come la sua massa per unità di volume. Si calcola dividendo la massa di un campione di sostanza per il suo volume. La densità del 4-etilfenolo è relativamente bassa a causa del suo basso peso molecolare e della mancanza di forti forze intermolecolari.
Peso molecolare del 4-etilfenolo
Il peso molecolare del 4-etilfenolo è 134,17 g/mol. Il peso molecolare è uguale alla massa molare e si calcola sommando le masse atomiche di tutti gli elementi della molecola. Nel caso del 4-etilfenolo, la sua formula molecolare (C8H10O) ci dà il peso molecolare di 134,17 g/mol.
| Aspetto | Liquido incolore |
| Peso specifico | 1,02 g/ml |
| Colore | Incolore |
| Odore | Odore dolce, speziato ed erbaceo |
| Massa molare | 134,17 g/mole |
| Densità | 1,02 g/ml |
| Punto di fusione | 9,7°C |
| Punto di ebollizione | 218,7°C |
| Punto flash | 100°C |
| solubilità in acqua | Solubile |
| Solubilità | Solubile in solventi organici |
| Pressione del vapore | 32 mmHg (20°C) |
| Densità del vapore | 2.4 (aria = 1) |
| pKa | 9.5 |
| pH | Neutro |
Sicurezza e pericoli del 4-etilfenolo
Conservare il 4-etilfenolo lontano da fonti di calore e accensione poiché è un liquido infiammabile. Il contatto diretto può causare irritazione alla pelle e agli occhi e l’inalazione dei suoi vapori o nebbie può causare irritazione alle vie respiratorie. Proteggiti indossando guanti protettivi, occhiali di sicurezza e un respiratore quando maneggi il 4-etilfenolo. Maneggiarlo con cura e smaltirlo correttamente in conformità con le normative locali.
| Simboli di pericolo | Liquido infiammabile, irritante |
| Descrizione della sicurezza | S2: Tenere fuori dalla portata dei bambini; S24/25: Evitare il contatto con la pelle e gli occhi; S36/37/39: Indossare indumenti protettivi, guanti e proteggersi gli occhi/il viso adeguati. |
| Numeri di identificazione delle Nazioni Unite | ONU 1993, Liquido infiammabile, NOS (4-etilfenolo) |
| Codice SA | 2909.30.90 |
| Classe di pericolo | 3 |
| Gruppo di imballaggio | III |
| Tossicità | LD50 orale (ratto) = 5.400 mg/kg. Può causare irritazione alla pelle e agli occhi. L’inalazione dei suoi vapori o nebbie può causare irritazione respiratoria. |
Metodi per la sintesi del 4-etilfenolo
Il 4-etilfenolo viene sintetizzato dalla reazione del fenolo con l’ossido di etilene in presenza di un catalizzatore alcalino, come l’idrossido di sodio o l’idrossido di potassio. La reazione avviene ad una temperatura di 60-80°C e a pressione atmosferica. Il rapporto molare tra fenolo e ossido di etilene varia da 1:1 a 1:2, a seconda della resa e della purezza desiderate del 4-etilfenolo. La miscela di reazione viene quindi neutralizzata e distillata per ottenere il prodotto desiderato.
Un metodo di sintesi alternativo prevede la reazione del 4-cloro-o-cresolo con ossido di etilene in presenza di un catalizzatore alcalino, come idrossido di sodio o idrossido di potassio. La reazione avviene ad una temperatura di 60-80°C e a pressione atmosferica. Il rapporto molare tra 4-cloro-o-cresolo e ossido di etilene varia da 1:1 a 1:2, a seconda della resa e della purezza desiderate del 4-etilfenolo. La miscela di reazione viene quindi neutralizzata e distillata per ottenere il prodotto desiderato.
È importante notare che entrambi i metodi richiedono un attento controllo della temperatura, della pressione e della concentrazione del catalizzatore per ottenere la resa e la purezza desiderate del 4-etilfenolo. La miscela di reazione deve inoltre essere attentamente monitorata per la presenza di impurità, come sottoprodotti della reazione o contaminanti provenienti dalle materie prime, per garantire la qualità del prodotto finale.
Usi del 4-etilfenolo
Le industrie utilizzano ampiamente il 4-etilfenolo come ingrediente profumato nei prodotti per la cura personale e per la casa come profumi, saponi, detergenti e candele a causa del suo odore dolce, speziato ed erbaceo. L’industria alimentare utilizza il 4-etilfenolo come agente aromatizzante nelle caramelle, nei prodotti da forno e nelle bevande alcoliche. Come precursore produce anche altri composti, come il p-cresolo, per l’industria farmaceutica e della chimica fine.
I produttori utilizzano il 4-etilfenolo nella produzione di resine, plastificanti e altri polimeri, nonché nella sintesi di gomma e fragranze sintetiche. I ricercatori stanno anche studiando il suo potenziale come agente antifungino grazie ai suoi effetti inibitori sulla crescita dei funghi.
Organismi di regolamentazione come l’Unione Europea, la Food and Drug Administration degli Stati Uniti e l’International Fragrance Association regolano l’uso del 4-etilfenolo per garantirne un uso sicuro e responsabile. L’uso sicuro del 4-etilfenolo richiede un’attenta considerazione dei suoi potenziali effetti sulla salute e sull’ambiente, nonché una corretta manipolazione e conservazione.
Domande:
Cosa sono gli etilfenoli?
Gli etilfenoli sono un gruppo di composti organici che contengono il gruppo funzionale fenolo e un gruppo etilico (-C2H5) attaccato all’anello fenolico. Sono classificati come alcoli aromatici e hanno proprietà fisiche e chimiche diverse a seconda della posizione del gruppo etilico sull’anello fenolico. Esempi comuni di etilfenoli includono 4-etilfenolo e 2-etilfenolo. Questi composti hanno vari usi nell’industria dei profumi, alimentare e chimica, nonché nella sintesi di altri prodotti chimici. Tuttavia, l’uso degli etilfenoli è regolamentato a causa delle preoccupazioni relative ai loro potenziali effetti sulla salute e sull’ambiente, e il loro utilizzo sicuro richiede un’attenta considerazione dei requisiti di manipolazione e stoccaggio.
Qual è la struttura del composto descritto dai dati spettrali riportati di seguito? formula c8h10o
I dati spettrali da soli non possono determinare in modo definitivo la struttura di un composto, ma possono fornire informazioni per identificarlo. La formula C8H10O suggerisce che il composto è un alcol aromatico, il che può essere confermato dalla presenza di un gruppo funzionale alcolico, indicato da un picco OH nello spettro IR.
Lo spettro 1H NMR potrebbe fornire informazioni sul numero e sul tipo di atomi di idrogeno nella molecola, come la presenza di idrogeni aromatici e idrogeni alifatici, nonché eventuali gruppi funzionali. Lo spettro 13C NMR potrebbe anche fornire informazioni sul tipo di atomi di carbonio presenti nella molecola e nel loro ambiente.
Sulla base di queste informazioni è possibile dedurre la struttura del composto, ma per confermarla definitivamente sarebbero necessarie ulteriori informazioni e analisi. Alcune possibili strutture per un composto con la formula C8H10O potrebbero includere, tra gli altri, fenolo, cresoli o xilenoli.
Quale pensi sia la struttura dello spettro NMR rappresentato dalla formula chimica c8h10o?
È possibile determinare la probabile struttura di una molecola con la formula chimica C8H10O come alcol aromatico. Ci si aspetterebbe di vedere un segnale singoletto o doppietto per il protone ossidrile e diversi picchi per il segnale del protone aromatico nello spettro 1H NMR. Nello spettro 13C NMR si vedono segnali per i carboni dell’anello aromatico e del gruppo carbonilico.
Diversi fattori come l’ambiente, il solvente e la concentrazione della molecola, nonché le impurità o gli isomeri, possono influire sugli spettri NMR. Per determinare in modo definitivo la struttura della molecola, è necessario analizzare e interpretare lo spettro NMR reale, sebbene sia possibile fare una previsione basata sulla formula chimica.
Come calcolare i gradi di insaturazione di c8h10o?
I gradi di insaturazione di una molecola possono essere calcolati utilizzando la formula:
Gradi di insaturazione = (2 + numero di anelli) + (numero di doppi legami / 2)
La molecola di formula C8H10O ha un solo anello perché è un anello aromatico. La molecola non ha doppi legami perché è un alcol e non contiene doppi legami.
Pertanto, i gradi di insaturazione per C8H10O verrebbero calcolati come segue:
Gradi di insaturazione = (2 + 1) + (0/2) = 3
Questo risultato indica che la molecola C8H10O ha tre gradi di insaturazione ed è quindi probabile che sia un alcol aromatico. Il calcolo dei gradi di insaturazione fornisce un modo rapido e conveniente per stimare la struttura molecolare di un composto e identificare se contiene gruppi o anelli funzionali insaturi. Va notato, tuttavia, che questo metodo presenta alcune limitazioni e non è adatto a tutti i composti.
Cos’è C8h10o?
C8H10O è la formula chimica di una molecola contenente 8 atomi di carbonio, 10 atomi di idrogeno e 1 atomo di ossigeno. La molecola può essere uno dei tanti composti chimici diversi, inclusi alcoli aromatici come fenolo, cresoli o xilenoli, tra gli altri.
Tecniche come la spettroscopia infrarossa, la spettroscopia di risonanza magnetica nucleare o la spettrometria di massa determinano la vera identità della molecola in base alla sua struttura e proprietà molecolari.
