L’etil 4-amminobenzoato, noto anche come benzocaina, è un anestetico locale comunemente utilizzato nelle procedure dentistiche e nei prodotti topici per alleviare il dolore. Funziona bloccando i segnali nervosi.
| Nome IUPAC | etil 4-amminobenzoato |
| Formula molecolare | C9H11NO2 |
| numero CAS | 94-09-7 |
| Sinonimi | Benzocaina, estere etilico dell’acido p-amminobenzoico, etil amminobenzoato, etil p-amminobenzoato, 4-(etossicarbonil)anilinio benzoato |
| InChI | InChI=1S/C9H11NO2/c1-2-12-9(11)7-3-5-8(10)6-4-7/h3-6H,2,10H2,1H3 |
Massa molare dell’etil 4-amminobenzoato:
La massa molare dell’etil 4-amminobenzoato è 165,19 g/mol. La massa molare è la massa di una mole di una sostanza e si calcola sommando le masse atomiche di tutti gli atomi di una molecola. La massa molare è un parametro importante nelle reazioni chimiche e viene utilizzata per determinare la quantità di sostanza presente in un campione.
Punto di ebollizione dell’etil 4-amminobenzoato:
Il punto di ebollizione dell’etil 4-amminobenzoato è 310,7°C. Il punto di ebollizione è la temperatura alla quale la tensione di vapore di un liquido eguaglia la pressione esterna. Al punto di ebollizione, una sostanza subisce una transizione di fase da liquida a gassosa. L’alto punto di ebollizione dell’etil 4-amminobenzoato lo rende un composto adatto per l’uso in procedure dentistiche e mediche che comportano temperature elevate.
Punto di fusione dell’etil 4-amminobenzoato:
Il punto di fusione dell’etil 4-amminobenzoato è 89-92°C. Il punto di fusione è la temperatura alla quale una sostanza solida passa allo stato liquido. Il punto di fusione di un composto dipende dalla sua struttura chimica, purezza e pressione. L’etil 4-amminobenzoato ha un basso punto di fusione, che lo rende facile da maneggiare e utilizzare nella preparazione di anestetici e analgesici topici.
Densità dell’etil 4-amminobenzoato g/ml:
La densità dell’etil 4-amminobenzoato è 1,17 g/mL. La densità è la quantità di massa per unità di volume di una sostanza. La densità di un composto dipende dal suo peso molecolare, dalla temperatura e dalla pressione. L’elevata densità dell’etil 4-amminobenzoato lo rende un composto pesante, che può essere facilmente misurato e utilizzato in quantità precise nelle reazioni chimiche.
Peso molecolare della benzocaina:
Il peso molecolare della benzocaina è 165,19 g/mol. Il peso molecolare è la somma dei pesi atomici di tutti gli atomi presenti in una molecola. Il peso molecolare di un composto è importante per determinarne le proprietà fisiche e chimiche.
Struttura della benzocaina:
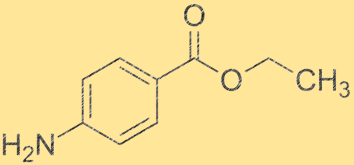
La struttura della benzocaina è una polvere cristallina bianca con la formula chimica C9H11NO2. Ha un anello benzenico a cui sono attaccati un gruppo carbossilico e un gruppo amminico. Il gruppo etilico è attaccato al gruppo amminico, rendendolo un derivato dell’acido benzoico. La struttura della benzocaina è importante per comprenderne le proprietà fisiche e chimiche.
Formula della benzocaina:
La formula chimica della benzocaina è C9H11NO2. È un derivato dell’acido benzoico e ha un gruppo etilico attaccato al gruppo amminico. La formula della benzocaina viene utilizzata per rappresentare la composizione del composto ed è importante per comprenderne le proprietà fisiche e chimiche.
| Aspetto | Polvere cristallina bianca |
| Peso specifico | 1,17 g/ml |
| Colore | Da incolore a bianco |
| Odore | Inodore |
| Massa molare | 165,19 g/mole |
| Densità | 1,17 g/ml |
| Punto di fusione | 89-92°C |
| Punto di ebollizione | 310,7°C |
| Punto flash | 164,2°C |
| solubilità in acqua | Leggermente solubile |
| Solubilità | Solubile in etanolo, cloroformio, etere |
| Pressione del vapore | 1,07E-07 mmHg a 25°C |
| Densità del vapore | 5.7 (contro aria) |
| pKa | 2.5 |
| pH | 6.5 – 7.5 |
Sicurezza e pericoli dell’etil 4-amminobenzoato
La benzocaina può causare irritazione alla pelle e agli occhi al contatto. L’ingestione o l’inalazione del composto può causare irritazione al sistema digestivo o respiratorio. L’esposizione prolungata o ripetuta alla benzocaina può causare danni al fegato o ai reni. Il composto non è considerato cancerogeno o mutageno, ma è necessario prestare attenzione quando lo si maneggia. Quando si maneggia la benzocaina è necessario indossare dispositivi di protezione individuale adeguati, come guanti e occhiali di sicurezza. In caso di ingestione o esposizione accidentale consultare immediatamente un medico. La benzocaina deve essere conservata in un luogo fresco e asciutto e lontano da fonti di ignizione o calore.
| Simboli di pericolo | XI |
| Descrizione della sicurezza | S22-S24/25-S36-S37 |
| Numeri di identificazione delle Nazioni Unite | Non regolato |
| Codice SA | 29224990 |
| Classe di pericolo | Irritante |
| Gruppo di imballaggio | Non regolato |
| Tossicità | LD50 (ratto, orale) = 940 mg/kg; LD50 (ratto, dermico) > 2 g/kg |
Metodi per la sintesi dell’etil 4-amminobenzoato
La benzocaina, nota anche come benzocaina, può essere sintetizzata con vari metodi. Un metodo comune prevede la reazione dell’acido p-amminobenzoico con etanolo in presenza di un catalizzatore acido forte, come acido solforico o acido cloridrico. L’estere etilico risultante dell’acido p-amminobenzoico viene quindi trattato con nitrito di sodio e acido cloridrico per formare il sale di diazonio. Questo sale reagisce quindi con l’acetato di sodio e l’anidride acetica per dare l’etil 4-acetossi-3-nitrobenzoato, che viene poi ridotto con stagno e acido cloridrico per produrre benzocaina.
Un altro metodo prevede la reazione della p-nitroanilina con l’etil cloroformiato in presenza di idrossido di sodio per formare l’etil p-nitrofenilcarbammato. Questo composto viene quindi ridotto con idrogeno gassoso e un catalizzatore di palladio per produrre benzocaina.
In un terzo metodo, l’etil 4-nitrobenzoato viene ridotto con polvere di zinco e acido cloridrico per produrre benzocaina.
Indipendentemente dal metodo di sintesi utilizzato, il composto risultante deve essere purificato mediante ricristallizzazione o altri metodi per ottenere un prodotto puro. La benzocaina è un anestetico locale comunemente usato ed è utilizzata anche nella produzione di vari prodotti farmaceutici e cosmetici.
Usi dell’etil 4-amminobenzoato
La benzocaina, un comune anestetico locale, intorpidisce l’area interessata e fornisce un sollievo temporaneo dal dolore e dal prurito causati da lievi irritazioni della pelle, mal di gola, mal di denti e dentizione. È disponibile in varie forme, come creme, gel, spray e pastiglie, ed è ampiamente utilizzato nei prodotti farmaceutici e cosmetici. È un ingrediente comune in gocce per la tosse, spray per la gola, gel antidolorifici, lozioni solari e balsami per labbra per alleviare il dolore causato da scottature solari e labbra screpolate.
L’industria alimentare utilizza anche la benzocaina come agente aromatizzante nelle caramelle, nelle gomme da masticare e in altri prodotti dolciari per produrre un effetto rinfrescante e anestetizzante. La Food and Drug Administration (FDA) degli Stati Uniti ne approva l’uso nei prodotti alimentari.
Tuttavia, la benzocaina deve essere utilizzata solo come indicato da un operatore sanitario o specificato sull’etichetta del prodotto per evitare effetti collaterali indesiderati come irritazione cutanea e reazioni allergiche. È quindi fondamentale utilizzarlo con cautela.
Domande:
L’etil 4-amminobenzoato è polare?
Sì, l’etil 4-amminobenzoato è polare. Ha un gruppo funzionale polare (il gruppo amminico) e un gruppo estere polare, che gli conferisce un momento dipolare netto. Ciò significa che ha una carica parziale positiva su un’estremità della molecola e una carica parziale negativa sull’altra estremità, rendendola polare. Questa proprietà della benzocaina la rende solubile in solventi polari, come acqua ed etanolo, e meno solubile in solventi non polari, come esano e benzene. La polarità dell’etil 4-amminobenzoato influisce anche sulle sue proprietà fisiche e chimiche, come il punto di fusione, il punto di ebollizione e la solubilità.
L’etil 4-amminobenzoato è solubile in acqua?
Sì, l’etil 4-amminobenzoato è parzialmente solubile in acqua. Ha un gruppo funzionale polare e un gruppo estere, che lo rende capace di formare legami idrogeno con le molecole d’acqua. Tuttavia, la sua solubilità in acqua è limitata a causa del gruppo etilico non polare presente nella sua struttura. Ciò significa che l’etil 4-amminobenzoato è più solubile in solventi organici, come etanolo e acetone, che in acqua. La solubilità dell’etil 4-amminobenzoato in acqua dipende anche da diversi fattori, quali la temperatura, il pH e la presenza di altre sostanze. In condizioni normali, la solubilità dell’etil 4-amminobenzoato in acqua è di circa 0,3 g/L a 25°C.
