2 Il butanone, noto anche come metiletilchetone o MEK, è un liquido incolore e infiammabile con un odore dolce e fruttato. È comunemente usato come solvente in varie applicazioni industriali e domestiche.
| Nome IUPAC | 2-Butanone |
| Formula molecolare | C4H8O |
| numero CAS | 78-93-3 |
| Sinonimi | Metiletilchetone (MEK), butan-2-one, 2-butanone, 3-ossobutan-2-one |
| InChI | InChI=1S/C4H8O/c1-3-4-5-2/h3-4H,1-2H3 |
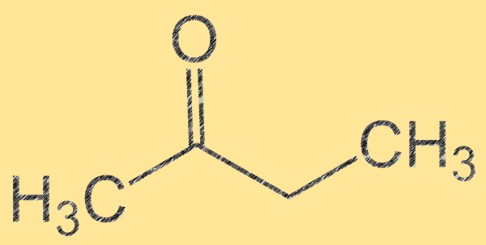
Struttura del butanone
Il butanone ha una formula molecolare C4H8O e la sua struttura molecolare può essere rappresentata come CH3C(O)CH2CH3. È un liquido incolore e infiammabile con un odore dolce e fruttato. Il butanone è un chetone, il che significa che contiene un gruppo carbonilico (C=O) attaccato a un atomo di carbonio. Questo gruppo carbonilico rende il butanone un importante intermedio nella sintesi di vari composti organici.
Massa molare del 2-butanone
Il butanone, noto anche come metil etil chetone (MEK), ha una massa molare di 72,11 g/mol. Questa è la quantità di sostanza contenuta in un dato campione di butanone, espressa in grammi per mole. La massa molare è una proprietà importante del butanone che viene utilizzata in vari calcoli ed esperimenti in chimica, ad esempio per determinare la massa di una sostanza necessaria per reagire con un’altra sostanza in un rapporto molare specifico. La massa molare del butanone può anche essere utilizzata per convertire la sua massa in moli, il che è utile in molte applicazioni tra cui reazioni chimiche, sintesi chimica e chimica analitica.
Punto di ebollizione del MEK
Il punto di ebollizione del MEK è 80,6°C (176,5°F). Questa è la temperatura alla quale il MEK passa da liquido a gassoso. Il punto di ebollizione è una proprietà importante del MEK perché influenza la sua capacità di evaporare e formare vapore. Ad esempio, in alcune applicazioni il MEK viene utilizzato come solvente ed è auspicabile che evapori rapidamente in modo che il soluto possa essere rimosso. In altre applicazioni, è auspicabile che il MEK rimanga nella sua forma liquida, in modo che possa essere utilizzato come solvente per reazioni effettuate al suo punto di ebollizione o al di sotto di esso.
MEK Punto di fusione
Il punto di fusione del MEK è -93,9°C (-136,0°F). Questa è la temperatura alla quale il MEK passa dallo stato solido a quello liquido. Il punto di fusione è una proprietà importante del MEK perché influenza la sua capacità di essere utilizzato come solvente per sostanze solide. Ad esempio, il MEK può essere utilizzato come solvente per alcuni solidi il cui punto di fusione è inferiore al proprio punto di fusione, come grassi, cere e resine.
Densità MEK g/ml
La densità del MEK è 0,80 g/mL. Questa è la massa per unità di volume di MEK ed è una proprietà importante utilizzata in molte applicazioni, incluso il calcolo della quantità di MEK richiesta per un volume specifico. La densità del MEK viene utilizzata anche per calcolare il suo volume molare, che è il volume occupato da una mole di MEK. Questa informazione è utile in vari esperimenti, inclusa la determinazione della massa molare di una sostanza.
Peso molecolare MEK
Il peso molecolare del MEK è 72,11 g/mol. È la somma dei pesi atomici degli atomi in una molecola MEK ed è una proprietà importante utilizzata in molte applicazioni, incluso il calcolo della massa molare di una sostanza. Il peso molecolare del MEK può essere utilizzato per convertire la sua massa in moli, il che è utile in molte applicazioni, comprese le reazioni chimiche, la sintesi chimica e la chimica analitica.
formula MEK
La formula chimica del MEK è C4H8O. Questa formula rappresenta le proporzioni relative.
| Aspetto | Liquido incolore |
| Peso specifico | 0,79 – 0,80 |
| Colore | Incolore |
| Odore | Dolce, fruttato |
| Massa molare | 72,11 g/mole |
| Densità | 0,79 – 0,80 g/ml |
| Punto di fusione | -93,9°C (-136,0°F) |
| Punto di ebollizione | 80,6°C (176,5°F) |
| Punto flash | 12°C (53,6°F) |
| solubilità in acqua | Solubile |
| Solubilità | Solubile nella maggior parte dei solventi organici |
| Pressione del vapore | 38 mmHg (20°C) |
| Densità del vapore | 2.3 (aria = 1) |
| pKa | 20.2 |
| pH | 7 (neutro) |
Nota: i valori forniti in questa tabella sono approssimativi e possono variare leggermente a seconda della sorgente e delle condizioni di misurazione.
Sicurezza e pericoli del butanone
Il butanone, noto anche come metiletilchetone, è un liquido infiammabile e volatile che può causare irritazione alla pelle, agli occhi e alle vie respiratorie se non maneggiato con adeguate precauzioni di sicurezza. L’inalazione di elevate concentrazioni di butanone può causare mal di testa, vertigini, nausea e perdita di coscienza. L’esposizione prolungata a basse concentrazioni di butanone può causare danni ai reni e al fegato. È anche altamente infiammabile e può accendersi facilmente, presentando pericolo di incendio. Quando si utilizza il butanone, è importante lavorare in un’area ben ventilata, indossare indumenti e occhiali protettivi ed evitare il contatto con la pelle. In caso di contatto con la pelle o con gli occhi, sciacquare immediatamente con acqua e, se necessario, consultare un medico. In caso di ingestione, non provocare il vomito e consultare immediatamente un medico. Il butanone deve essere conservato in un luogo fresco, asciutto e ben ventilato, lontano da fonti di calore e fiamme.
| Simboli di pericolo | Liquido infiammabile, Irritante |
| Descrizione della sicurezza | S2 – Tenere fuori dalla portata dei bambini<br>S16 – Conservare lontano da fonti di accensione<br>S24/25 – Evitare il contatto con la pelle e gli occhi<br>S26 – In caso di contatto con gli occhi, lavare immediatamente e abbondantemente con acqua e chiedere consiglio al medico |
| Identificatori AN | UN1090 |
| Codice SA | 29141100 |
| Classe di pericolo | 3 (Liquido infiammabile) |
| Gruppo di imballaggio | II |
| Tossicità | LD50 (orale, ratto) – 4.220 mg/kg |
Metodi di sintesi del butanone
Il butanone può essere sintetizzato con diversi metodi, inclusa l’ossidazione diretta del 2-butanolo e la condensazione aldolica dell’acetone e del 2-propanolo.
Il metodo di ossidazione diretta prevede la reazione del 2-butanolo con un agente ossidante come acido cromico, perossido di idrogeno o una miscela di acido nitrico e acido solforico. La reazione avviene in ambiente acido e il metiletilchetone risultante viene separato dalla miscela di reazione mediante distillazione.
Il metodo della condensazione aldolica prevede la reazione dell’acetone con il 2-propanolo in presenza di una base forte come l’idrossido di sodio o l’idrossido di potassio. La reazione produce una miscela di metiletilchetone e altri sottoprodotti, che vengono separati mediante distillazione.
Un altro metodo di sintesi prevede la reazione dell’acetone con formaldeide in presenza di un catalizzatore come acido solforico o acido p-toluensolfonico. Questa reazione produce una miscela di metiletilchetone, formaldeide e altri sottoprodotti, che vengono separati mediante distillazione.
Nel complesso, la sintesi del metiletilchetone richiede un attento controllo delle condizioni di reazione per garantire la produzione di un prodotto di alta qualità con sottoprodotti minimi. È importante seguire le adeguate precauzioni di sicurezza quando si lavora con le sostanze chimiche e le reazioni coinvolte nella sintesi del metiletilchetone.
Usi del butanone
Il butanone, noto anche come metiletilchetone, ha un’ampia gamma di usi industriali grazie alla sua solvibilità, volatilità e basso punto di ebollizione. Alcuni degli usi più comuni del butanone includono:
- Solvente: il metiletilchetone viene utilizzato come solvente per varie sostanze come resine, adesivi, inchiostri, svernicianti, inchiostri da stampa, lacche nitrocellulosiche e gomme sintetiche.
- Detergente: l’industria elettronica lo utilizza come detergente per pulire le parti e le superfici metalliche da grasso, olio e altri contaminanti.
- Prodotti farmaceutici: nell’industria farmaceutica, il metiletilchetone viene utilizzato come solvente nella produzione di vaccini, antibiotici e altri farmaci.
- Rivestimenti: i rivestimenti per legno, carta e altri materiali utilizzano anche il metiletilchetone come solvente nella loro produzione, nonché nella fabbricazione di vernici, lacche e altri rivestimenti protettivi.
- Profumi: l’industria cosmetica e quella alimentare utilizzano il metiletilchetone come solvente per profumi e aromi.
- Adesivi: adesivi e sigillanti utilizzano anche il metiletilchetone come solvente nella loro produzione.
Oltre ai suoi usi industriali, il metiletilchetone è stato studiato anche per il suo potenziale come combustibile. Il suo alto contenuto energetico e la bassa tossicità rispetto ad altri combustibili lo rendono una promettente fonte di energia alternativa.
Domande:
Cosa darà la seguente reazione? Catalizzatore 2-butanone + h2/ni
La reazione del 2-butanone con idrogeno gassoso su un catalizzatore di nichel è nota come reazione di idrogenazione. Questa reazione darà il seguente prodotto:
2-butanone + H2 -> 2-butanolo
La riduzione del doppio legame tra gli atomi di carbonio e di ossigeno nel gruppo chetonico del 2-butanone determina la formazione di 2-butanolo mediante l’attivazione dell’idrogeno gassoso da parte di un catalizzatore di nichel. L’industria chimica utilizza comunemente questa reazione per produrre 2-butanolo, un prezioso solvente e materia prima per altre produzioni chimiche. Per un’idrogenazione efficiente e selettiva del 2-butanone in 2-butanolo è necessario un attento controllo della temperatura, della pressione e del tipo di catalizzatore.
Il 2 butanone è un chetone?
La chimica organica caratterizza il 2-butanone, noto anche come metil etil chetone, come un tipo di chetone con un gruppo carbonilico (C=O) legato a un atomo di carbonio all’interno di una catena idrocarburica. Il gruppo carbonilico del 2-butanone risiede tra due atomi di carbonio, da qui la sua etichetta “metiletilchetone”.
Qual è lo spettro infrarosso del 2-butanone?
Lo spettro IR (infrarosso) del 2-butanone (noto anche come metil etil chetone) può fornire importanti informazioni sulla sua struttura molecolare e sui gruppi funzionali. Lo spettro IR del 2-butanone mostra generalmente le seguenti bande principali di assorbimento:
- Stretching del carbonile: questa banda appare come un picco netto tra 1700 e 1700 cm^-1 ed è caratteristica del gruppo funzionale C=O del chetone.
- Stretching alchilico: i picchi tra 2900 e 3000 cm^-1 corrispondono alle vibrazioni di stretching dei gruppi CH2 e CH3 nel 2-butanone.
- Flessione CH: i picchi tra 1400 e 1500 cm^-1 corrispondono alle vibrazioni di flessione dei legami CH nel 2-butanone.
- Flessione del COC: il picco tra 1300 e 1400 cm^-1 corrisponde alle vibrazioni di flessione del gruppo COC nel 2-butanone.
È importante notare che lo spettro IR del 2-butanone sarà influenzato dalla preparazione del campione e dagli strumenti utilizzati, nonché dalla presenza di impurità o contaminanti.
