L’1-butene (C4H8) è un gas incolore con un leggero odore dolciastro. Viene utilizzato nella produzione di polietilene e come materia prima per altri prodotti chimici.
| Nome IUPAC | Mais-1-ène |
| Formula molecolare | C4H8 |
| numero CAS | 106-98-9 |
| Sinonimi | Butilene, Etilene, Vinilmetilene |
| InChI | 1S/C4H8/c1-3-4-2/h3-4H,1-2H3 |
Proprietà dell’1-butene
Formula 1-Butene
La formula chimica dell’1-butene è C4H8, che rappresenta il numero e il tipo di atomi presenti nella molecola. La formula indica che l’1-butene contiene quattro atomi di carbonio e otto atomi di idrogeno. La formula dell’1-butene è utile per determinarne il peso molecolare e calcolarne la reattività nelle reazioni chimiche.
Massa molare di 1-butene
L’1-butene, noto anche come But-1-ene, ha una massa molare di 56,11 g/mol. La massa molare si riferisce alla massa di una mole di una sostanza e viene calcolata sommando le masse atomiche di ciascun atomo in una molecola. Nel caso del but-1-ene, la molecola contiene quattro atomi di carbonio e otto atomi di idrogeno, ciascuno con la rispettiva massa atomica.
Punto di ebollizione dell’1-butene
Il but-1-ene ha un punto di ebollizione di -6,3°C o 20,7°F. Il punto di ebollizione si riferisce alla temperatura alla quale un liquido si trasforma in un gas ad una pressione fissa. Poiché il but-1-ene è un gas a temperatura ambiente, richiede un basso punto di ebollizione per mantenere il suo stato gassoso. Il punto di ebollizione del but-1-ene è influenzato da fattori quali la pressione e la presenza di altre sostanze chimiche.
1-Punto di fusione del butene
Il but-1-ene ha un punto di fusione di -185,4°C o -301,7°F. Il punto di fusione si riferisce alla temperatura alla quale un solido si trasforma in un liquido ad una pressione fissa. Poiché il but-1-ene è un gas a temperatura ambiente, non esiste allo stato solido. Tuttavia, il punto di fusione del but-1-ene rimane un parametro utile per determinarne le proprietà fisiche e chimiche.
Densità dell’1-butene g/mL
Il but-1-ene ha una densità di 0,573 g/mL a temperatura ambiente. La densità si riferisce alla quantità di massa per unità di volume di una sostanza. La densità del but-1-ene è inferiore a quella dell’acqua, che ha una densità di 1 g/mL, indicando che il but-1-ene è meno denso dell’acqua. La densità del but-1-ene è influenzata da fattori quali temperatura e pressione.
Peso molecolare del 1-butene
Il but-1-ene ha un peso molecolare di 56,11 g/mol. Il peso molecolare è la somma dei pesi atomici di tutti gli atomi presenti in una molecola. Il peso molecolare del but-1-ene è un fattore importante nel determinare le sue proprietà fisiche e chimiche, nonché il suo comportamento nelle reazioni chimiche.
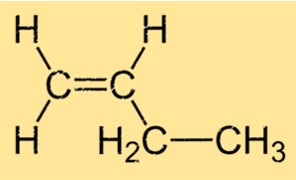
Struttura 1-butene
Il but-1-ene ha una struttura lineare, con quattro atomi di carbonio legati tra loro in una catena lineare e ciascun atomo di carbonio legato a due atomi di idrogeno. La formula molecolare del but-1-ene è C4H8 e appartiene al gruppo degli idrocarburi chiamati alcheni. Il doppio legame tra il primo e il secondo atomo di carbonio della molecola è responsabile della sua reattività nelle reazioni chimiche.
| Aspetto | Gas incolore |
| Peso specifico | 0,573 |
| Colore | Incolore |
| Odore | Leggero odore dolce |
| Massa molare | 56,11 g/mole |
| Densità | 0,573 g/ml a temperatura ambiente |
| Punto di fusione | -185,4°C o -301,7°F |
| Punto di ebollizione | -6,3°C o 20,7°F |
| Punto flash | -70°C (-94°F) |
| solubilità in acqua | Insolubile |
| Solubilità | Solubile in solventi organici |
| Pressione del vapore | 278,4 kPa a 20°C |
| Densità del vapore | 2,98 (aria = 1) |
| pKa | 45.1 |
| pH | Neutro |
Sicurezza e pericoli del 1-butene
Ma-1-ene è un gas infiammabile e può formare miscele esplosive con l’aria. È anche irritante per gli occhi, la pelle e il sistema respiratorio. L’esposizione ad alte concentrazioni di but-1-ene può causare vertigini, nausea e mal di testa. Pertanto, durante la manipolazione del but-1-ene è necessario utilizzare un’adeguata ventilazione e dispositivi di protezione. È importante conservare e maneggiare il but-1-ene lontano da fonti di ignizione e materiali incompatibili. In caso di perdita o sversamento, l’area deve essere immediatamente evacuata e seguite le procedure di risposta all’emergenza. Inoltre, dovrebbero essere utilizzati metodi di smaltimento adeguati per evitare la contaminazione ambientale.
| Simboli di pericolo | F+ (altamente infiammabile) |
| Descrizione della sicurezza | Tenere lontano da fonti di ignizione. Utilizzare solo in aree ben ventilate. Indossare dispositivi di protezione. |
| Numeri di identificazione delle Nazioni Unite | ONU 1012 |
| Codice SA | 290110 |
| Classe di pericolo | 2.1 (Gas infiammabile) |
| Gruppo di imballaggio | Gruppo II |
| Tossicità | L’inalazione di elevate concentrazioni può causare depressione del sistema nervoso centrale. |
Metodi per la sintesi dell’1-butene
Vari metodi possono sintetizzare but-1-ene, compreso il cracking catalitico di frazioni di petrolio greggio o la disidratazione del butanolo.
Un metodo comune è la deidrogenazione catalitica dei buteni, che comporta la rimozione degli atomi di idrogeno dai buteni per formare butene-1. Diversi catalizzatori, come cromo-allumina, cromite di rame o platino, possono eseguire questo processo.
Un altro metodo prevede la dimerizzazione selettiva dell’etilene, seguita dalla disidratazione dei buteni risultanti per formare but-1-ene. I catalizzatori zeolitici, come ZSM-5 o SAPO-11, possono implementare questo processo.
Un complesso tungsteno-carbene può catalizzare la reazione di metatesi tra propilene ed etilene per produrre but-1-ene. Questo metodo è interessante perché permette di produrre but-1-ene da risorse rinnovabili, come l’etilene di origine biologica.
Usi dell’1-butene
But-1-ene è un composto chimico versatile che trova un’ampia gamma di applicazioni industriali e commerciali. Alcuni usi comuni di but-1-ene includono:
- Produzione di polietilene: utilizzato come co-monomero nella produzione di polietilene ad alta densità e lineare a bassa densità. L’aggiunta di 1-butene aiuta a migliorare le proprietà meccaniche e termiche del polimero.
- Intermedi chimici: utilizzati come intermedi chimici nella produzione di vari prodotti chimici, come butadiene, buteni, butirraldeide e butanolo.
- Carburante e additivi per carburante: utilizzato come carburante o additivo per carburante grazie al suo elevato numero di ottano e alle proprietà di combustione pulita.
- Refrigeranti: Utilizzato come refrigerante grazie al suo basso punto di ebollizione e alla natura non infiammabile.
- Adesivi: utilizzati nella produzione di adesivi hot melt. Questi sono comunemente usati nell’industria dell’imballaggio.
- Gomma e plastica: utilizzata come materia prima per la produzione di gomma sintetica e plastica, come il polibutene.
- Lubrificanti: utilizzati come additivo lubrificante per migliorare le proprietà lubrificanti e antiusura dei lubrificanti.
- Industria farmaceutica: utilizzato come materia prima nella sintesi di vari prodotti farmaceutici.
Domande:
D: Perché potrebbe essere difficile visualizzare la separazione di cis- e trans-2-butene mediante TLC?
R: Può essere difficile visualizzare la separazione di cis- e trans-2-butene mediante TLC perché questi isomeri hanno proprietà fisiche e chimiche molto simili. Ciò può provocare macchie sovrapposte sulla piastra TLC, rendendo difficile la distinzione tra i due isomeri.
D: Qual è la massa molare dell’1-butene se 5,38 × 1016 molecole di 1-butene pesano 5,00 μg?
R: La massa molare del but-1-ene può essere calcolata utilizzando il numero di molecole indicato e il peso del campione. La massa molare del but-1-ene è 56,11 g/mol.
D: Il tuo compito è convertire il 2-bromobutano in 1-butene con la massima resa. Che reagenti utilizzeresti?
R: Un metodo possibile per convertire il 2-bromobutano in but-1-ene consiste nell’eseguire una reazione di eliminazione E2 utilizzando una base forte, come il terz-butossido di potassio (KOtBu), in un solvente aprotico polare, come il dimetilsolfossido (DMSO ). tetraidrofurano dell’oro (THF).
D: Come preparare l’1-butene?
R: Il but-1-ene può essere prodotto con vari metodi, come la deidrogenazione catalitica dei buteni, la dimerizzazione selettiva dell’etilene seguita dalla disidratazione o la reazione di metatesi tra propilene ed etilene. Questi metodi coinvolgono catalizzatori e condizioni di reazione diversi e occorre prestare particolare attenzione per garantire un’elevata resa e purezza del prodotto finale.
