L’isopropanol (alcool isopropylique), également connu sous le nom d’alcool à friction, est un composé chimique incolore et inflammable. Il est largement utilisé comme solvant, désinfectant et antiseptique en raison de ses propriétés fortes et efficaces.
| Nom UICPA | Propane-2-ol |
| Formule moléculaire | C3H8O |
| Numero CAS | 67-63-0 |
| Synonymes | Alcool isopropylique, 2-propanol, alcool sec-propylique, diméthylcarbinol, IPA, alcool à friction |
| InChI | InChI=1S/C3H8O/c1-3(2)4/h3-4H,1-2H3 |
Propriétés de l’isopropanol
Structure de l’alcool isopropylique
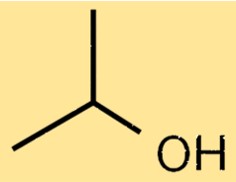
La structure de l’alcool isopropylique est constituée d’une chaîne propane avec un groupe hydroxyle (-OH) attaché à l’atome de carbone central. Le groupe hydroxyle confère à l’alcool isopropylique ses propriétés caractéristiques en tant qu’alcool, notamment sa capacité à se dissoudre dans l’eau et à agir comme solvant pour de nombreux composés organiques. La présence d’un groupe méthyle (-CH3) sur le premier atome de carbone de la chaîne propane confère à l’alcool isopropylique ses propriétés uniques, notamment ses points d’ébullition et de fusion relativement bas.
Alcool isopropylique Masse molaire
La masse molaire de l’alcool isopropylique, également appelé alcool à friction, est de 60,1 g/mol. La masse molaire est la masse d’une mole d’une substance, qui correspond à la quantité d’une substance contenant le même nombre d’entités qu’il y a d’atomes dans 12 grammes de carbone 12. Dans le cas de l’alcool isopropylique, une mole de substance contient 60,1 grammes. La masse molaire est un paramètre important dans de nombreux calculs chimiques, notamment pour déterminer la quantité d’une substance nécessaire à une réaction ou la concentration d’une solution.
Alcool isopropylique Point d’ébullition
Le point d’ébullition de l’alcool isopropylique est de 82,6 °C (180,7 °F) à pression atmosphérique. Le point d’ébullition est la température à laquelle une substance passe d’un liquide à un gaz, et c’est une propriété physique déterminée par les forces intermoléculaires de la substance. L’alcool isopropylique a un point d’ébullition relativement bas par rapport à d’autres alcools, comme l’éthanol, en raison de sa petite taille et de la présence d’un groupe méthyle.
Alcool isopropylique Point de fusion
Le point de fusion de l’alcool isopropylique est de -89 °C (-128,2 °F). Le point de fusion est la température à laquelle une substance passe d’un solide à un liquide, et c’est également une propriété physique déterminée par les forces intermoléculaires de la substance. L’alcool isopropylique a un point de fusion relativement bas par rapport aux autres alcools en raison de sa petite taille et de la présence d’un groupe méthyle.
Alcool isopropylique Densité g/mL
La densité de l’alcool isopropylique est de 0,786 g/mL à température ambiante (20 °C ou 68 °F). La densité est la masse d’une substance par unité de volume et c’est une propriété physique déterminée par la structure atomique et moléculaire de la substance. L’alcool isopropylique a une densité inférieure à celle de l’eau, qui a une densité de 1 g/mL à température ambiante.
Alcool isopropylique Poids moléculaire
Le poids moléculaire de l’alcool isopropylique est de 60,1 g/mol. Le poids moléculaire est la somme des poids atomiques de tous les atomes d’une molécule et constitue une propriété caractéristique de la substance. L’alcool isopropylique a un poids moléculaire relativement faible par rapport à d’autres alcools, tels que l’éthanol, qui a un poids moléculaire de 46,1 g/mol.
Alcool isopropylique Formule
La formule chimique de l’alcool isopropylique est C3H8O. Cette formule représente le nombre et les types d’atomes qui composent la molécule d’alcool isopropylique. La formule montre que l’alcool isopropylique contient trois atomes de carbone, huit atomes d’hydrogène et un atome d’oxygène. Cette formule est utile pour déterminer le poids moléculaire et d’autres propriétés physiques et chimiques de l’alcool isopropylique.
| Apparence | Liquide clair et incolore |
| Gravité spécifique | 0,786 g/mL à 20 °C |
| Couleur | Incolore |
| Odeur | Caractéristique, alcoolique |
| Masse molaire | 60,1 g/mole |
| Densité | 0,786 g/mL à 20 °C |
| Point de fusion | -89 °C (-128,2 °F) |
| Point d’ébullition | 82,6 °C (180,7 °F) à pression atmosphérique |
| Point d’éclair | 12,2 °C (54 °F) |
| Solubilité dans l’eau | Complètement miscible |
| Solubilité | Miscible avec les solvants organiques |
| La pression de vapeur | 33,8 mmHg à 20 °C |
| Densité de vapeur | 2,07 (air = 1) |
| pKa | 16,5 |
| pH | 7 (neutre) |
Sécurité et dangers de l’isopropanol
L’isopropanol est un liquide hautement inflammable et volatil avec un point d’éclair faible et doit être manipulé avec précaution. Il peut provoquer une irritation de la peau et des yeux, et une exposition prolongée ou répétée peut entraîner un dessèchement et des gerçures de la peau. L’isopropanol peut également provoquer une irritation respiratoire et des étourdissements en cas d’inhalation, et son ingestion peut entraîner des nausées, des vomissements et des douleurs abdominales. Il est important d’utiliser un équipement de protection approprié tel que des gants, des lunettes et un respirateur lorsque vous travaillez avec de l’isopropanol. Le stockage doit s’effectuer dans un endroit frais, sec et bien ventilé, à l’écart des sources de chaleur et des matériaux incompatibles.
| Symboles de danger | F, Xi |
| Description de la sécurité | Liquide et vapeurs hautement inflammables. Provoque une grave irritation des yeux. Provoque une irritation cutanée. Nocif en cas d’ingestion. Suspecté de provoquer des anomalies génétiques. Suspecté de nuire à la fertilité ou à l’enfant à naître. Peut provoquer somnolence ou vertiges. |
| Identifiants ONU | UN1219 |
| Code SH | 2905.12.0000 |
| Classe de danger | 3 |
| Groupe d’emballage | II |
| Toxicité | DL50 (orale, rat) : 5 630 mg/kg |
Méthodes de synthèse de l’isopropanol
L’isopropanol, également connu sous le nom d’alcool isopropylique, peut être synthétisé par diverses méthodes.
Une méthode courante implique l’hydratation du propylène à l’aide d’un catalyseur tel que l’acide sulfurique ou l’acide phosphorique. Le processus implique la réaction du propylène avec de l’eau en présence du catalyseur pour produire de l’isopropanol et de l’éther diisopropylique comme sous-produit.
Une autre méthode implique l’hydrogénation de l’acétone à l’aide d’un catalyseur tel que le chromite de cuivre ou le nickel. Le processus utilise de l’hydrogène gazeux et le catalyseur pour réduire l’acétone en isopropanol.
Certaines souches de bactéries peuvent produire de l’isopropanol par fermentation de glucides, comme le maïs ou la canne à sucre. Le processus comprend la conversion des glucides en glucose, qui est ensuite fermenté par les bactéries pour produire de l’isopropanol.
Une autre méthode de synthèse de l’isopropanol implique la réaction d’un réactif de Grignard avec du formaldéhyde , suivie d’une hydrolyse catalysée par un acide. Cette méthode est particulièrement utile pour produire de l’isopropanol avec un degré de pureté élevé.
Quelle que soit la méthode utilisée, l’isopropanol obtenu doit être purifié par distillation ou par d’autres méthodes pour éliminer toutes les impuretés et atteindre le niveau de pureté souhaité.
Utilisations de l’isopropanol
L’isopropanol, également connu sous le nom d’alcool isopropylique, a de nombreuses utilisations dans diverses industries et applications. Certaines des utilisations courantes de l’isopropanol sont :
- Solvant : Solvant efficace pour une variété de substances, notamment les huiles, les résines et les gommes. Utilisé comme solvant dans la fabrication de revêtements, d’encres et d’adhésifs.
- Désinfectant : Utilisé comme désinfectant dans les établissements de santé, les laboratoires et autres milieux. Il est efficace contre de nombreux agents pathogènes, notamment les bactéries, les virus et les champignons.
- Antiseptique : Utilisé comme antiseptique dans diverses applications topiques, telles que les désinfectants pour les mains et les lingettes désinfectantes. Également utilisé dans la préparation de la peau aux procédures médicales.
- Agent de nettoyage : utilisé dans diverses applications de nettoyage, telles que le nettoyage de composants électroniques, de lentilles optiques et d’instruments de précision.
- Carburant : Utilisé comme additif pour carburant dans les moteurs à essence et diesel. Il est également utilisé comme carburant dans certaines voitures de course.
- Agent d’extraction : utilisé comme agent d’extraction dans la production d’huiles essentielles, d’arômes et de parfums.
- Intermédiaire chimique : utilisé comme intermédiaire chimique dans la production de divers produits chimiques, tels que l’acétone, l’acétate d’isopropyle et le glycérol.
Des questions:
Q : L’alcool isopropylique est-il polaire ?
R : Oui, l’alcool isopropylique est une molécule polaire. Il possède un groupe hydroxyle (-OH) attaché à une chaîne de trois atomes de carbone, ce qui en fait une molécule polaire. Cette polarité en fait un bon solvant pour de nombreuses substances.
Q : L’alcool isopropylique est-il la même chose que l’alcool à friction ?
R : L’alcool à friction est un type d’alcool fabriqué à partir d’alcool isopropylique ou d’éthanol. L’alcool isopropylique est l’un des principaux ingrédients de l’alcool à friction, avec l’eau et d’autres composés. Ainsi, même si l’alcool isopropylique n’est pas exactement la même chose que l’alcool à friction, il s’agit d’un composant clé de l’alcool à friction.
Q : Où acheter de l’alcool isopropylique ?
R : L’alcool isopropylique peut être acheté auprès de diverses sources, notamment les pharmacies, les épiceries et les détaillants en ligne. Il est couramment vendu à des concentrations allant de 70 % à 99 %, la concentration de 70 % étant la plus courante. Il est important de noter qu’en raison de la forte demande et des pénuries, l’alcool isopropylique peut être difficile à trouver dans certaines régions.
