L’isoprène (C5H8) est un composé organique naturel utilisé dans la production de caoutchouc, de plastiques et d’autres matériaux. Il joue un rôle crucial dans la formation d’ozone et la pollution atmosphérique.
| Nom UICPA | 2-méthylbuta-1,3-diène |
| Formule moléculaire | C₅H₈ |
| Numero CAS | 78-79-5 |
| Synonymes | Isoprène, 2-méthyl-1,3-butadiène, β-isoprène |
| InChI | InChI=1S/C₅H₈/c1-4-5(2)3/h4H,1-2H3 |
Propriétés de l’isoprène
Formule isoprène
La formule de l’isoprène est C₅H₈. Il est constitué de cinq atomes de carbone et de huit atomes d’hydrogène. La structure moléculaire de l’isoprène est caractérisée par une chaîne ramifiée avec une double liaison entre le deuxième et le troisième atome de carbone.
Isoprène Masse molaire
La masse molaire du 2-méthyl-1,3-butadiène peut être calculée en additionnant les masses atomiques de ses éléments constitutifs. Le carbone a une masse molaire de 12,01 g/mol, tandis que l’hydrogène a une masse molaire de 1,01 g/mol. Ainsi, la masse molaire du 2-méthyl-1,3-butadiène est d’environ 68,12 g/mol.
Point d’ébullition de l’isoprène
L’isoprène a un point d’ébullition d’environ 34 °C (93 °F). Ce point d’ébullition relativement bas le rend volatil et sujet à l’évaporation à température ambiante.
Point de fusion de l’isoprène
Le point de fusion du 2-méthyl-1,3-butadiène est d’environ -145 °C (-229 °F). A cette température, le 2-méthyl-1,3-butadiène passe de l’état solide à l’état liquide.
Densité d’isoprène g/mL
La densité du 2-méthyl-1,3-butadiène est d’environ 0,69 g/mL. Cette valeur représente la masse de 2-méthyl-1,3-butadiène par unité de volume et est influencée par son poids moléculaire et sa disposition structurelle.
Isoprène Poids moléculaire
Le poids moléculaire du 2-méthyl-1,3-butadiène est déterminé en additionnant les poids atomiques de ses atomes constitutifs. Avec une formule C₅H₈, le poids moléculaire du 2-méthyl-1,3-butadiène est d’environ 68,12 g/mol.
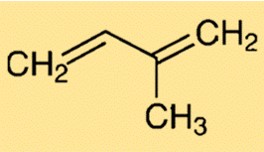
Structure isoprène
La structure du 2-méthyl-1,3-butadiène est caractérisée par une chaîne ramifiée de cinq atomes de carbone. Il contient une double liaison entre le deuxième et le troisième atome de carbone. Cette structure confère flexibilité et réactivité au 2-méthyl-1,3-butadiène, ce qui en fait un élément clé dans la synthèse de divers composés.
Solubilité de l’isoprène
L’isoprène est peu soluble dans l’eau mais se dissout facilement dans les solvants organiques comme l’éthanol et l’acétone. Ses caractéristiques de solubilité sont attribuées à la nature non polaire de sa structure moléculaire.
Ces notes donnent un aperçu des propriétés clés du 2-méthyl-1,3-butadiène, notamment sa formule, sa masse molaire, son point d’ébullition, son point de fusion, sa densité, son poids moléculaire, sa structure et sa solubilité. Comprendre ces propriétés est essentiel pour étudier et utiliser le 2-méthyl-1,3-butadiène dans diverses applications industrielles.
| Apparence | Liquide incolore |
| Gravité spécifique | 0,68 – 0,70 g/mL |
| Couleur | Incolore |
| Odeur | Doux, piquant |
| Masse molaire | 68,12 g/mole |
| Densité | 0,68 – 0,70 g/mL |
| Point de fusion | -145 °C (-229 °F) |
| Point d’ébullition | 34 °C (93 °F) |
| Point d’éclair | -40 °C (-40 °F) |
| Solubilité dans l’eau | Peu soluble |
| Solubilité | Soluble dans les solvants organiques |
| Pression de vapeur | 290 mmHg à 25 °C |
| Densité de vapeur | 2,49 (air = 1) |
| pKa | ~ 40 |
| pH | Neutre |
Sécurité et dangers de l’isoprène
L’isoprène ou le 2-méthyl-1,3-butadiène présente certains risques pour la sécurité qui doivent être pris en compte. Il est hautement inflammable et peut former des mélanges vapeur-air explosifs. Il convient donc de le manipuler avec précaution à proximité de flammes nues ou de sources de chaleur. L’exposition à l’isoprène peut entraîner une irritation de la peau et des yeux. Un contact prolongé ou répété peut provoquer une dermatite. L’inhalation de vapeurs de 2-méthyl-1,3-butadiène peut provoquer une irritation respiratoire, des étourdissements et des maux de tête. Il est important d’utiliser une ventilation adéquate et un équipement de protection individuelle lorsque vous travaillez avec du 2-méthyl-1,3-butadiène. En cas d’ingestion, des soins médicaux immédiats sont nécessaires. Il est conseillé de stocker le 2-méthyl-1,3-butadiène dans un endroit frais et bien ventilé, à l’écart des sources d’inflammation.
| Symboles de danger | Inflammable (F), Irritant (Xi) |
| Description de la sécurité | Tenir à l’écart de la chaleur/des étincelles/des flammes nues/des surfaces chaudes. Éviter de respirer les poussières/fumées/gaz/brouillards/vapeurs/aérosols. Porter des gants de protection/un équipement de protection des yeux/du visage. Conserver dans un endroit bien ventilé. |
| Numéros d’identification de l’ONU | ONU 1214 |
| Code SH | 2902.41.00 |
| Classe de danger | Classe 3 (Liquides inflammables) |
| Groupe d’emballage | GE II |
| Toxicité | Peut provoquer une irritation de la peau et des yeux. Nocif en cas d’ingestion. |
Méthodes de synthèse de l’isoprène
Diverses méthodes peuvent synthétiser le 2-méthyl-1,3-butadiène. Une méthode courante consiste à craquer thermiquement des matières premières à base de pétrole, telles que le naphta ou les gaz légers, en présence de catalyseurs. Ce processus produit un mélange de composés, dont le 2-méthyl-1,3-butadiène, que nous pouvons séparer et purifier.
Une autre méthode consiste à déshydrogéner catalytiquement l’isopentane ou l’isobutane . Dans des conditions contrôlées et à l’aide d’un catalyseur, ces hydrocarbures subissent une réaction de déshydrogénation aboutissant à la production de 2-méthyl-1,3-butadiène.
Nous pouvons également obtenir du 2-méthyl-1,3-butadiène à partir de sources renouvelables par des voies biologiques. En modifiant génétiquement des micro-organismes comme les bactéries et les levures, nous leur permettons de produire du 2-méthyl-1,3-butadiène par des voies métaboliques. Cette approche offre une alternative durable et respectueuse de l’environnement aux méthodes de synthèse traditionnelles.
De plus, la pyrolyse de la biomasse, un processus thermochimique, peut générer du 2-méthyl-1,3-butadiène ainsi que d’autres produits chimiques précieux. Soumettre les matériaux de biomasse à des températures élevées en l’absence d’oxygène décompose les composés organiques complexes de la biomasse, libérant du 2-méthyl-1,3-butadiène comme l’un des produits résultants.
Dans l’ensemble, la synthèse du 2-méthyl-1,3-butadiène englobe une gamme de méthodes, notamment le craquage thermique, la déshydrogénation catalytique, les voies biologiques et la pyrolyse de la biomasse. Ces diverses approches contribuent à la disponibilité du 2-méthyl-1,3-butadiène pour diverses applications industrielles tout en tenant compte des aspects environnementaux et durables.
Utilisations de l’isoprène
L’isoprène joue un rôle crucial dans diverses industries en raison de ses propriétés uniques et de sa réactivité. Il trouve de nombreuses applications dans les domaines suivants :
- Production de caoutchouc : les fabricants utilisent le 2-méthyl-1,3-butadiène comme monomère essentiel pour produire du caoutchouc synthétique, notamment le poly2-méthyl-1,3-butadiène et le caoutchouc styrène-butadiène (SBR). Ils utilisent ces caoutchoucs pour fabriquer des pneus, des bandes transporteuses, des tuyaux et divers produits en caoutchouc moulé.
- Production de polymères : L’isoprène sert d’élément de base dans la production de diverses résines polymères et élastomères. Les industries l’utilisent pour synthétiser des élastomères thermoplastiques, des adhésifs, des revêtements et des produits d’étanchéité.
- Intermédiaires chimiques : L’isoprène s’avère polyvalent en tant qu’intermédiaire chimique dans la production d’une large gamme de produits chimiques. Il facilite la synthèse de produits pharmaceutiques, de parfums, d’arômes, d’antioxydants et d’autres produits chimiques spécialisés.
- Formation d’ozone : L’isoprène contribue de manière significative à la chimie atmosphérique en réagissant avec les oxydes d’azote (NOx) et la lumière du soleil pour former de l’ozone. Ce processus affecte la qualité de l’air et contribue à la formation de smog.
- Additif de carburant : Les industries utilisent le 2-méthyl-1,3-butadiène comme additif de carburant pour améliorer l’efficacité de combustion et les caractéristiques de performance de l’essence. Il améliore l’indice d’octane et réduit les cognements du moteur.
- Recherche et développement : L’isoprène joue un rôle important dans les études de recherche et développement, en particulier dans les domaines de la chimie, de la science des matériaux et des sciences de l’environnement. Les chercheurs l’utilisent largement comme outil précieux pour étudier de nouvelles réactions, développer des matériaux innovants et étudier la chimie atmosphérique.
Les diverses applications du 2-méthyl-1,3-butadiène soulignent son importance dans de multiples industries, allant de la fabrication du caoutchouc à la synthèse chimique, tout en jouant également un rôle dans la recherche environnementale et scientifique.
Des questions:
Q : Quelle est la règle de l’isoprène ?
R : La règle du 2-méthyl-1,3-butadiène stipule que de nombreux composés naturels peuvent être dérivés du 2-méthyl-1,3-butadiène, qui est constitué de cinq atomes de carbone et a une structure ramifiée.
Q : Combien d’unités isoprène contient l’alpha-ylangène ?
R : L’alpha-ylangène contient trois unités 2-méthyl-1,3-butadiène, car il possède une chaîne linéaire de 15 atomes de carbone dérivés de trois éléments constitutifs du 2-méthyl-1,3-butadiène.
Q : Combien d’unités isoprène sont utilisées pour synthétiser une molécule de cholestérol ?
R : La synthèse d’une molécule de cholestérol nécessite 18 unités 2-méthyl-1,3-butadiène, qui sont combinées et modifiées par une série de réactions enzymatiques.
Q : Combien d’unités d’isoprène contient le cholestérol ?
R : Le cholestérol contient quatre anneaux fusionnés et est composé de 30 unités 2-méthyl-1,3-butadiène.
Q : Comment identifier les unités isoprène ?
R : Les unités 2-méthyl-1,3-butadiène peuvent être identifiées par leur structure caractéristique, constituée d’une chaîne ramifiée de cinq atomes de carbone avec une double liaison entre le deuxième et le troisième atomes de carbone.
Q : Quelle est la position du groupe menthyle sur l’isoprène ?
R : Le groupe menthyle est généralement situé au quatrième atome de carbone d’une unité 2-méthyl-1,3-butadiène.
Q : L’anneau à 4 carbones est-il en isoprène ?
R : Non, un cycle à 4 carbones n’est pas un 2-méthyl-1,3-butadiène. Le 2-méthyl-1,3-butadiène fait référence à une unité spécifique à cinq carbones avec une structure ramifiée et une double liaison.
Q : Combien d’unités d’isoprène contient le squalène ?
R : Le squalène, un triterpène, est composé de six unités 2-méthyl-1,3-butadiène, ce qui donne une molécule de 30 atomes de carbone.
