L’isobutylène (C₄H₈) est un gaz incolore utilisé dans la production de carburants et de produits chimiques. Il est hautement inflammable et dégage une odeur sucrée.
| Nom UICPA | 2-méthylpropène |
| Formule moléculaire | C₄H₈ |
| Numero CAS | 115-11-7 |
| Synonymes | Isobutène, 2-méthylpropène, méthylpropène |
| InChI | InChI=1S/C4H8/c1-4(2)3/h1H2,2-3H3 |
Propriétés de l’isobutylène
Formule isobutylène
La formule de l’isobutène est C₄H₈. Il est constitué de quatre atomes de carbone et de huit atomes d’hydrogène. Cette formule moléculaire représente la composition de l’isobutène, montrant le nombre de chaque type d’atome présent dans une molécule.
Isobutylène Masse molaire
La masse molaire de l’isobutène est calculée en additionnant les masses atomiques de ses atomes constitutifs. C’est environ 56,11 grammes par mole (g/mol). La masse molaire est un paramètre crucial dans les calculs chimiques et est utilisée pour déterminer la quantité de substance présente dans une quantité donnée.
Point d’ébullition de l’isobutylène
L’isobutylène a un point d’ébullition d’environ -6,9 degrés Celsius. Le point d’ébullition fait référence à la température à laquelle une substance passe d’une phase liquide à une phase gazeuse sous une pression atmosphérique standard. L’isobutylène se vaporise à cette température et se transforme en gaz.
Isobutylène Point de fusion
Le point de fusion de l’isobutène est d’environ -140,3 degrés Celsius. Le point de fusion est la température à laquelle une substance solide passe à l’état liquide. L’isobutylène subit ce changement lorsqu’il est chauffé à la température spécifiée.
Densité de l’isobutylène g/mL
La densité de l’isobutène est d’environ 0,588 grammes par millilitre (g/mL). La densité représente la masse par unité de volume d’une substance. Il détermine le degré de densité des molécules dans un volume donné du matériau.
Isobutylène Poids moléculaire
Le poids moléculaire de l’isobutène est d’environ 56,11 grammes par mole (g/mol). Le poids moléculaire est la somme des poids atomiques de tous les atomes d’une molécule. Il est essentiel pour divers calculs, notamment la stœchiométrie et la détermination de la proportion de différents éléments dans un composé.
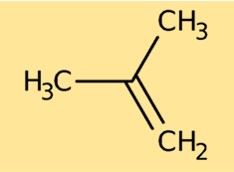
Structure de l’isobutylène
L’isobutène a une structure constituée d’une chaîne ramifiée de quatre atomes de carbone. Chaque atome de carbone est lié à d’autres atomes, notamment aux atomes d’hydrogène. La structure est représentée par CH₃C(CH₃)CH₂. Cet arrangement d’atomes détermine les propriétés chimiques et physiques de l’isobutène.
Solubilité de l’isobutylène
L’isobutène est peu soluble dans l’eau. Il présente une faible solubilité en raison de sa nature apolaire. Les composés non polaires comme l’isobutène ne se dissolvent pas facilement dans les solvants polaires comme l’eau. Cependant, l’isobutène peut se dissoudre dans des solvants organiques tels que les alcools, les éthers et les hydrocarbures.
| Apparence | Gaz incolore |
| Gravité spécifique | 0,588 |
| Couleur | N / A |
| Odeur | Doux |
| Masse molaire | 56,11 g/mole |
| Densité | 0,588 g/ml |
| Point de fusion | -140,3 °C |
| Point d’ébullition | -6,9 °C |
| Point d’éclair | -49 °C |
| Solubilité dans l’eau | Peu soluble |
| Solubilité | Soluble dans les solvants organiques |
| Pression de vapeur | 215 kPa (à 25 °C) |
| Densité de vapeur | 2,48 (air = 1) |
| pKa | N / A |
| pH | Neutre |
Sécurité et dangers de l’isobutylène
L’isobutène présente plusieurs risques pour la sécurité. Il est hautement inflammable, ce qui signifie qu’il peut s’enflammer facilement lorsqu’il est exposé à une source d’inflammation. Par conséquent, des précautions appropriées doivent être prises pour éviter les incendies et les explosions. Les vapeurs d’isobutène sont plus lourdes que l’air et peuvent s’accumuler dans les zones basses, augmentant ainsi le risque d’incendie. Le contact direct avec l’isobutène peut provoquer une irritation de la peau et des yeux. L’inhalation de concentrations élevées peut entraîner des problèmes respiratoires, des étourdissements et même une asphyxie. Une ventilation adéquate et un équipement de protection individuelle doivent être utilisés lors de la manipulation de l’isobutène afin de minimiser les risques d’exposition. Il est essentiel de suivre les protocoles de sécurité appropriés et de manipuler cette substance avec prudence.
| Symboles de danger | Gaz inflammable |
| Description de la sécurité | Tenir à l’écart des sources d’inflammation. |
| Utiliser dans un endroit bien ventilé. | |
| Portez des vêtements et des lunettes de protection. | |
| Identifiants des Nations Unies | ONU 1075 |
| Code SH | 2901.11.00 |
| Classe de danger | 2.1 (Gaz inflammable) |
| Groupe d’emballage | GE II |
| Toxicité | Toxicité aiguë par inhalation, nocive par ingestion ou par contact avec la peau/les yeux. |
Méthodes de synthèse de l’isobutylène
Il existe différentes méthodes pour synthétiser l’isobutène.
Une méthode courante implique la déshydrogénation catalytique de l’isobutane, où l’isobutane passe sur un catalyseur, généralement un oxyde métallique ou un catalyseur métallique supporté, à des températures élevées. Le catalyseur facilite l’élimination de l’hydrogène de l’isobutane, entraînant la formation d’isobutène.
Une autre méthode consiste à craquer thermiquement des fractions pétrolières riches en hydrocarbures ramifiés, tels que les butènes, en appliquant des températures élevées. La réaction de craquage décompose les molécules d’hydrocarbures les plus grosses en molécules plus petites, produisant de l’isobutène.
Lors du vapocraquage des hydrocarbures, le procédé produit de l’isobutène comme sous-produit. Le vapocraquage consiste à soumettre des hydrocarbures, tels que l’éthane ou le naphta, à des températures élevées en présence de vapeur, entraînant l’obtention d’un mélange d’oléfines, dont l’isobutène.
De plus, la synthèse de l’isobutène implique de réaliser une réaction de métathèse entre l’éthylène et le 2-butène . Les réactions de métathèse impliquent l’échange de groupes fonctionnels ou de substituants entre les molécules réactives. En soumettant l’éthylène et le 2-butène à des conditions de métathèse, on peut produire de l’isobutène.
Ces méthodes de synthèse offrent différentes approches pour obtenir de l’isobutène, répondant à diverses exigences industrielles et à la disponibilité des matières premières. Chaque méthode présente ses propres avantages et considérations en termes de conditions de réaction, de sélection du catalyseur et d’optimisation du rendement.
Utilisations de l’isobutylène
L’isobutène joue un rôle crucial dans un large éventail d’applications en raison de ses propriétés uniques. Certaines utilisations courantes de l’isobutène comprennent :
- L’isobutène est une matière première clé dans la production de caoutchouc butyle, que les fabricants utilisent pour créer des chambres à air de pneus, des flexibles automobiles, des joints et des joints, grâce à son excellente résistance à la chaleur, aux produits chimiques et à son imperméabilité aux gaz.
- Les industries utilisent l’isobutène comme additif pour carburant pour améliorer l’indice d’octane de l’essence, améliorant ainsi l’efficacité de la combustion et réduisant les cliquetis pour de meilleures performances du carburant.
- L’isobutène subit une polymérisation pour produire du polyisobutène (PIB), un polymère polyvalent largement utilisé dans diverses applications industrielles telles que les lubrifiants, les adhésifs, les produits d’étanchéité et comme agent épaississant.
- Les fabricants utilisent l’isobutène comme précurseur dans la production d’alcool isobutylique, un solvant largement utilisé dans les revêtements, les résines et les produits de soins personnels.
- L’isobutène agit comme un élément de base pour la synthèse de divers produits chimiques, notamment des antioxydants, des plastifiants, des arômes, des parfums et des produits pharmaceutiques, démontrant ainsi son rôle d’intermédiaire chimique précieux.
- Les industries ajoutent de l’isobutène au gaz de pétrole liquéfié (GPL) comme composant de mélange pour améliorer sa qualité et sa stabilité, garantissant ainsi une utilisation sûre et efficace.
- Il trouve une application en tant que composant dans les mélanges de réfrigérants utilisés dans les systèmes de réfrigération et de climatisation.
- Les industries s’appuient sur des adhésifs à base d’isobutène pour leurs fortes propriétés de liaison, et les utilisent dans les secteurs de la construction, de l’automobile et de l’emballage.
- L’isobutène sert d’agent d’extraction dans la production de divers produits chimiques, notamment des produits pharmaceutiques et des arômes.
- Il agit comme propulseur dans les produits en aérosol tels que les sprays, les mousses et les déodorants.
Ces applications démontrent l’importance de l’isobutène dans diverses industries et ses contributions à de nombreux produits du quotidien.
Des questions:
Q : Combien pèse un gallon d’isobutylène ?
R : Un gallon d’isobutène pèse environ 4,88 livres (lb).
Q : Qu’est-ce que l’isobutylène ?
R : L’isobutène est un gaz incolore utilisé dans la production de carburants, de produits chimiques et de caoutchouc synthétique.
Q : L’isobutylène contient-il des isomères cis ou trans ?
R : L’isobutène n’a pas d’isomères cis ou trans car il s’agit d’un hydrocarbure ramifié.
Q : L’isobutylène a-t-il un groupe vinyle ?
R : Oui, l’isobutylène contient un groupe vinyle, plus précisément une double liaison entre deux atomes de carbone.
Q : L’isobutylène est-il présent dans le RP1 ?
R : Non, l’isobutène n’est pas un composant du RP-1 (Rocket Propellant-1), qui est une forme hautement raffinée de kérosène.
Q : Pourquoi l’isobutylène (-7°C) a-t-il un point d’ébullition inférieur à celui de l’acétone (56°C) ?
R : L’isobutène a un point d’ébullition plus bas que l’acétone en raison de son poids moléculaire plus faible et de ses forces intermoléculaires plus faibles.
Q : Lequel des composés suivants est approprié pour favoriser la polymérisation cationique de l’isobutylène ?
R : Les acides de Lewis tels que le trifluorure de bore (BF3) ou le chlorure d’aluminium (AlCl3) peuvent être utilisés pour favoriser la polymérisation cationique de l’isobutylène.
Q : Comment l’isobutylène est-il stocké ?
R : L’isobutène est généralement stocké dans des conteneurs ou des cylindres sous pression pour le maintenir à l’état gazeux.
Q : Quel(s) bromure(s) organique(s) subirait une déshydrohalogénation E2 pour donner de l’isobutylène sous forme d’alcène pur ?
R : Le 2-bromobutane (bromure de sec-butyle) ou le bromure de tert-butyle peut subir une déshydrohalogénation E2 pour produire de l’isobutylène sous forme d’alcène pur.
