L’ion carbonate, CO32-, est un ion chargé négativement composé d’un atome de carbone, de trois atomes d’oxygène et d’une charge globale de -2. On le trouve couramment dans des minéraux tels que la calcite et la dolomite, ainsi que dans des solutions aqueuses sous forme de bicarbonate. Il joue un rôle crucial dans le contrôle des niveaux de pH dans l’océan et d’autres plans d’eau.
| Nom UICPA | Ion Carbonate |
| Formule moléculaire | CO32- |
| Numero CAS | 497-19-8 |
| Synonymes | Acide carbonique, Trioxyde de carbone |
| InChI | InChI=1S/CH2O3.2K/c2-1(3)4;/h(H2,2,3,4);/q;+2/p-2 |
Propriétés des ions carbonate
Formule Carbonate
La formule de l’ion carbonate est représentée par CO3^2-, où C représente le carbone, O représente l’oxygène et le symbole 2- représente la charge négative de l’ion. Cette formule indique qu’il y a trois atomes d’oxygène et un atome de carbone dans l’ion carbonate, lui donnant sa structure moléculaire caractéristique.
Charge de Carbonate CO3
L’ion carbonate, CO3^2-, a une charge négative 2 en raison de la présence de trois atomes d’oxygène et d’un atome de carbone dans sa formule chimique. La charge négative résulte de la présence d’électrons supplémentaires dans l’ion carbonate, ce qui en fait un ion chargé négativement.
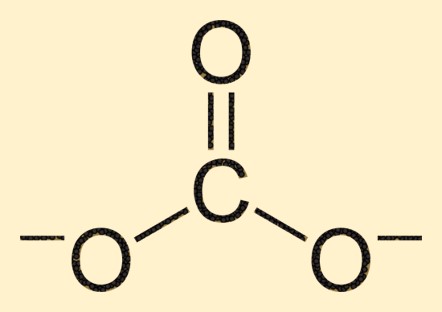
Structure carbonatée
L’ion carbonate est composé d’un atome de carbone en son centre, entouré de trois atomes d’oxygène dans un arrangement plan trigonal. L’atome de carbone forme une double liaison avec un atome d’oxygène, tandis que les deux autres atomes d’oxygène sont liés à l’atome de carbone par des liaisons simples. Cette structure confère à l’ion CO3 2- sa forme et ses propriétés caractéristiques.
Carbonate Ion Poids moléculaire
Le poids moléculaire de l’ion carbonate est d’environ 60,01 g/mol, calculé sur la base des poids atomiques de ses éléments constitutifs (carbone, oxygène). Le poids moléculaire de l’acide carbonique est important pour déterminer la quantité d’acide carbonique dans un échantillon, ainsi que pour déterminer ses propriétés physiques et chimiques.
| Apparence | Poudre blanche solide |
| Gravité spécifique | 2.5 |
| Couleur | Blanc |
| Odeur | Aucun |
| Masse molaire | 100,09 g/mole |
| Densité | 2,83 g/cm3 |
| Point de fusion | 825°C |
| Point d’ébullition | 1484°C |
| Point d’éclair | N’est pas applicable |
| Solubilité dans l’eau | Soluble dans l’eau |
| Solubilité | Soluble dans les acides |
| Pression de vapeur | N’est pas applicable |
| Densité de vapeur | N’est pas applicable |
| PKa | 10h33 |
| PH | 8.6 |
Sécurité et dangers des ions carbonate
L’ion carbonate, CO32-, est largement utilisé dans diverses industries, mais il doit être manipulé avec prudence. L’inhalation de niveaux élevés de poussière de carbonate peut provoquer des problèmes respiratoires, tandis que son ingestion en grande quantité peut entraîner des problèmes digestifs. Le contact avec la peau peut provoquer des irritations et des lésions cutanées. Il est également inflammable et peut réagir avec d’autres produits chimiques pour produire des gaz dangereux. Il est important de suivre les mesures de sécurité, telles que le port d’un équipement de protection individuelle et le stockage des ions carbonate dans des conteneurs appropriés, afin de minimiser les risques d’accidents.
| Symbole de danger | Aucun |
| Description de la sécurité | Il n’est pas considéré comme dangereux et n’est associé à aucun symbole de danger spécifique. |
| ID ONU | N / A |
| Code SH | N / A |
| Classe de danger | N / A |
| Groupe d’emballage | N / A |
| Toxicité | Non toxique |
Méthodes de synthèse d’ions carbonate
Les ions carbonate (CO3 2- ) peuvent être synthétisés par diverses méthodes différentes. La méthode la plus courante de production d’ions CO3 2- consiste à faire réagir le dioxyde de carbone et l’eau. Cette réaction produit une solution d’acide carbonique, qui peut ensuite être neutralisée avec un alcali, tel que l’hydroxyde de sodium, pour produire de l’acide carbonique. L’acide carbonique peut également être produit par électrolyse d’une solution saline, où les ions carbonate se forment à la cathode. Ces ions peuvent également être produits en laboratoire par une réaction chimique entre un acide et un sel carbonate.
Utilisations des ions carbonate
Les industries utilisent largement l’acide carbonique à diverses fins. Les fabricants de levure chimique, les producteurs d’antiacides et les entreprises de boissons incorporent généralement de l’acide carbonique dans leurs produits. L’industrie du traitement de l’eau contrôle les niveaux de pH dans l’eau potable et les piscines à l’aide d’ions carbonate. L’industrie du bâtiment utilise les ions CO3 2- comme composant principal du ciment pour fabriquer du béton. Les agriculteurs ajoutent des ions carbonate au sol pour améliorer son alcalinité et favoriser la croissance des cultures. L’industrie chimique utilise les ions carbonate comme catalyseur et réactif dans diverses réactions chimiques. L’industrie agroalimentaire préserve les aliments en incorporant des ions carbonate. En raison de leur polyvalence, les ions carbonate jouent un rôle essentiel dans de nombreux produits quotidiens et processus industriels.
