Qu’est-ce que l’Ammonium NH4+ ?
L’ion ammonium (NH4+) est un ion polyatomique chargé positivement constitué d’un atome d’azote et de quatre atomes d’hydrogène. On le trouve couramment dans les engrais et les composés organiques.
| Nom UICPA | Azanium |
| Formule moléculaire | NH4+ |
| Numero CAS | 14798-03-9 |
| Synonymes | Cation ammonium, tétrahydridonitrogène (1+), aminonium, azanium, cation hydrure d’azote, hydroazote, ion azote |
| InChI | InChI=1S/H3N/h1H3/p+1 |
Remarque : InChI concerne l’ion ammonium dans sa forme la plus simple, avec un seul hydrogène ionisé. L’InChI réel peut varier en fonction de l’environnement chimique de l’ion ammonium.
Formule d’ammonium
La formule de l’ion ammonium est NH4+. C’est un cation polyatomique composé d’un atome d’azote et de quatre atomes d’hydrogène. L’ion ammonium est formé par la protonation de l’ammoniac (NH3) avec un ion hydrogène (H+). L’ion ammonium est un cation courant dans les composés inorganiques et organiques, notamment les engrais, les produits pharmaceutiques et les explosifs.
Cation d’ammonium
Le cation ammonium, également connu sous le nom de NH4+, est un ion polyatomique chargé positivement composé d’un atome d’azote et de quatre atomes d’hydrogène. Il se forme lorsque l’ammoniac (NH3) accepte un proton (H+) d’un acide, entraînant la formation de sel d’ammonium.
Masse molaire des ions ammonium
La masse molaire de l’ion ammonium (NH4+) est de 18,04 g/mol. Cette valeur est calculée en additionnant les masses atomiques d’un atome d’azote (14,01 g/mol) et de quatre atomes d’hydrogène (1,01 g/mol chacun). La masse molaire est une propriété importante de l’ion ammonium car elle permet la conversion de sa masse en moles et vice versa. Ceci est utile dans de nombreux calculs chimiques, tels que la détermination de la quantité de réactifs nécessaires à une réaction chimique.
Point d’ébullition des ions ammonium
Étant donné que l’ion ammonium se trouve généralement dans un sel, tel que le chlorure d’ammonium (NH4Cl), il n’a pas de point d’ébullition qui lui est propre. Au lieu de cela, le point d’ébullition du chlorure d’ammonium, qui est de 520 °C, est influencé par divers facteurs tels que la force de la liaison ionique entre l’ion ammonium et l’ion chlorure, ainsi que la taille et la forme de l’ion ammonium.
Point de fusion des ions ammonium
Semblable au point d’ébullition, l’ion ammonium n’a pas de point de fusion car ce n’est pas une substance qui existe sous forme pure. Cependant, les sels contenant l’ion ammonium, comme le nitrate d’ammonium (NH4NO3), ont un point de fusion de 169,6 °C. Le point de fusion du nitrate d’ammonium est influencé par la force de la liaison ionique entre l’ion ammonium et l’ion nitrate, ainsi que par la structure cristalline du composé.
Densité des ions ammonium g/ml
La densité de l’ion ammonium (NH4+) n’est pas applicable car il s’agit d’un ion polyatomique et n’existe pas en tant qu’entité distincte. Cependant, les sels contenant l’ion ammonium, comme le sulfate d’ammonium (NH4)2SO4, ont une densité de 1,77 g/cm³ à température ambiante. La densité des sels contenant l’ion ammonium est influencée par divers facteurs, notamment la taille et la forme des ions, la force de la liaison ionique et la structure cristalline du composé.
Poids moléculaire des ions ammonium
Le poids moléculaire de l’ion ammonium (NH4+) est de 18,04 g/mol, calculé en additionnant les masses atomiques d’un atome d’azote et de quatre atomes d’hydrogène. Le poids moléculaire est une propriété importante de l’ion ammonium car il permet la conversion de sa masse en moles et vice versa. Ceci est utile dans de nombreux calculs chimiques, tels que la détermination de la quantité de réactifs nécessaires à une réaction chimique.
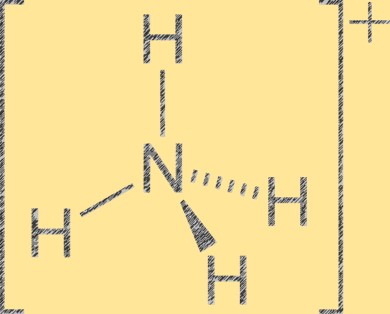
Structure des ions ammonium
L’ion ammonium (NH4+) a une géométrie moléculaire tétraédrique avec un atome d’azote au centre et quatre atomes d’hydrogène aux coins du tétraèdre. L’atome d’azote a une charge formelle positive de +1, tandis que chaque atome d’hydrogène a une charge formelle de -1. L’ion ammonium est un cation polyatomique formé par la protonation de l’ammoniac (NH3) avec un ion hydrogène (H+). L’ion ammonium est un cation courant dans les composés inorganiques et organiques, notamment les engrais, les produits pharmaceutiques et les explosifs.
| Apparence | Gaz solide cristallin blanc ou incolore |
| Gravité spécifique | Sans objet (ion polyatomique) |
| Couleur | Incolore |
| Odeur | Inodore |
| Masse molaire | 18,04 g/mole |
| Densité | Non applicable (ion polyatomique), la densité des sels varie (par exemple 1,77 g/cm³ pour le sulfate d’ammonium) |
| Point de fusion | Non applicable (ion polyatomique), le point de fusion des sels varie (par exemple 169,6 °C pour le nitrate d’ammonium) |
| Point d’ébullition | Non applicable (ion polyatomique), le point d’ébullition des sels varie (par exemple 520 °C pour le chlorure d’ammonium) |
| Point d’éclair | Sans objet (ion polyatomique) |
| Solubilité dans l’eau | Très soluble (complètement miscible) dans l’eau |
| Solubilité | Soluble dans les alcools et l’ammoniaque liquide |
| La pression de vapeur | Sans objet (ion polyatomique) |
| Densité de vapeur | Sans objet (ion polyatomique) |
| pKa | 9,25 (acide conjugué, cation ammonium) |
| pH | 7 (neutre) en solution aqueuse |
Remarque : Les valeurs présentées dans le tableau peuvent varier en fonction de la forme chimique et des conditions spécifiques de l’ion ammonium.
Sécurité et dangers des ions ammonium
L’ion ammonium, sous sa forme pure, est généralement considéré comme sûr et non toxique. Cependant, comme de nombreux composés chimiques, l’ion ammonium peut présenter certains dangers et risques, notamment s’il est manipulé ou utilisé de manière inappropriée. L’ion ammonium peut libérer du gaz ammoniac toxique lorsqu’il réagit avec des bases fortes ou des acides forts. Cela peut également constituer un risque d’incendie et d’explosion lorsqu’il est exposé à la chaleur ou à une flamme. De plus, l’exposition à des concentrations élevées d’ions ammonium ou de ses dérivés peut provoquer une irritation des yeux, de la peau et du système respiratoire. Il est important de suivre les protocoles de sécurité appropriés et de manipuler l’ion ammonium et ses dérivés avec soin pour éviter les dangers potentiels.
| Symboles de danger | Aucun attribué pour l’ion ammonium pur |
| Description de la sécurité | Nocif en cas d’ingestion, inhalation ou absorption par la peau. Provoque une irritation de la peau, des yeux et des voies respiratoires. Peut libérer du gaz ammoniac toxique. Peut présenter un risque d’incendie et d’explosion. |
| ID ONU | 3077 (pour les composés d’ammonium, y compris les sels d’ammonium) |
| Code SH | 2827.10.00 (pour le chlorure d’ammonium, le carbonate d’ammonium et autres sels d’ammonium) |
| Classe de danger | 9 (Substances et objets dangereux divers) pour les composés d’ammonium, Classe 8 (Substances corrosives) pour la solution d’hydroxyde d’ammonium |
| Groupe d’emballage | III (pour les composés d’ammonium) |
| Toxicité | Généralement considéré comme non toxique sous sa forme pure, mais peut libérer du gaz ammoniac toxique. Les composés et dérivés de l’ammonium peuvent être toxiques ou nocifs pour la santé humaine et l’environnement en fonction de leurs propriétés spécifiques et de leur utilisation. |
Méthodes de synthèse des ions ammonium
L’ion ammonium peut être synthétisé à l’aide de diverses méthodes, notamment des réactions chimiques et des processus biologiques.
Une méthode courante pour synthétiser l’ion ammonium consiste à faire réagir l’ammoniac gazeux avec un acide, tel que l’acide chlorhydrique ou l’acide sulfurique, pour produire du sel d’ammonium. La réaction implique le déplacement des ions hydrogène (H+) dans l’acide par des molécules d’ammoniac, entraînant la formation de cation ammonium (NH4+) et de l’anion correspondant de l’acide (par exemple chlorure, sulfate). Le sel d’ammonium résultant peut être purifié et cristallisé pour obtenir un ion ammonium.
Des processus biologiques, tels que la dégradation de la matière organique par les microbes, peuvent également entraîner la formation d’ions ammonium. Au cours de ce processus, les composés contenant de l’azote sont décomposés par des bactéries et d’autres micro-organismes, produisant de l’ammoniac et éventuellement des ions ammonium. Ce processus est connu sous le nom d’ammonification et constitue une étape importante dans le cycle de l’azote.
Une autre méthode de synthèse de l’ion ammonium consiste à utiliser le procédé Haber-Bosch, qui implique la réaction de l’azote gazeux et de l’hydrogène gazeux en présence d’un catalyseur à haute pression et température. L’ammoniac gazeux résultant peut ensuite réagir avec un acide pour produire un ion ammonium.
Utilisations des ions ammonium
L’ion ammonium a diverses utilisations dans les milieux industriels, agricoles et en laboratoire.
Il sert un large éventail d’environnements industriels, agricoles et de laboratoire, car il agit principalement comme engrais en agriculture, fournissant de l’azote facilement disponible aux plantes tout en réduisant le pH du sol.
L’industrie chimique utilise l’ion ammonium comme ingrédient clé dans la production de divers composés, tels que des engrais, des explosifs et des produits pharmaceutiques, ainsi que dans la synthèse d’antibiotiques et d’autres produits pharmaceutiques. L’ion ammonium fonctionne également comme un explosif sous forme de nitrate d’ammonium.
Dans les laboratoires, les chercheurs utilisent l’ion ammonium comme réactif dans de nombreuses réactions chimiques, telles que les réactions de précipitation et la synthèse organique, et comme agent tampon pour stabiliser le pH de la solution.
De plus, l’ion ammonium est utilisé dans les produits de nettoyage ménagers comme agent antimicrobien en raison de sa capacité à tuer les bactéries et les champignons.
Les multiples utilisations de l’ion ammonium et sa polyvalence en font un composé essentiel dans diverses industries et applications.
