L’ion acétate (C2H3O2-) est un anion composé d’un atome de carbone, de deux atomes d’hydrogène et d’un atome d’oxygène, largement présent en chimie organique et en biochimie.
| Nom UICPA | Éthanoate |
| Formule moléculaire | C2H3O2- |
| Numero CAS | 127-09-3 |
| Synonymes | Anion acide acétique ; Anion acide éthanoïque ; Anion acétate |
| InChI | InChI=1S/C2H4O2/c1-2(3)4/h1H3,(H,3,4)/p-1 |
Charge d’acétate
L’ion acétate est un anion, ce qui signifie qu’il porte une charge négative. L’ion acétate est dérivé de l’acide acétique , qui est un acide organique faible qui se dissocie dans l’eau pour former des ions hydrogène (H+) et des ions acétate (C2H3O2-). L’ion acétate a une charge de -1 et c’est un ion courant dans les systèmes biologiques et dans de nombreuses réactions chimiques.
Formule Acétate
L’ion acétate a la formule chimique C2H3O2-. C’est un ion chargé négativement composé de deux atomes de carbone, trois atomes d’hydrogène et deux atomes d’oxygène. L’ion acétate est la base conjuguée de l’acide acétique , qui répond à la formule chimique CH3COOH. L’ion acétate forme des sels avec des ions chargés positivement tels que le sodium (Na+) et le calcium (Ca2+) pour produire respectivement de l’acétate de sodium (CH3COO-Na+) et de l’acétate de calcium (CH3COO-Ca2+).
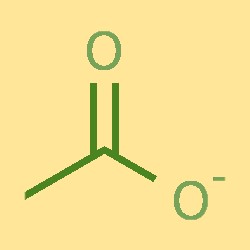
Structure des ions acétate
L’ion acétate est constitué d’un atome de carbone, de deux atomes d’hydrogène et d’un atome d’oxygène. L’atome de carbone est lié à un atome d’oxygène et à deux atomes d’hydrogène, formant une structure COH. L’atome d’oxygène est également lié à un ion chargé négativement. L’ion acétate a une forme plane trigonale, avec des angles de liaison d’environ 120°.
Acétate Ion Masse molaire
La masse molaire de l’ion acétate (C2H3O2) est de 59,04 g/mol. Il est calculé en additionnant les poids atomiques de tous les atomes de l’ion. La masse molaire est importante pour déterminer la quantité de substance présente dans un échantillon.
Point d’ébullition des ions acétate
Le point d’ébullition de l’ion acétate n’est pas applicable car il s’agit d’un ion chargé négativement et n’existe pas en tant que molécule autonome. Cependant, le point d’ébullition de l’acide acétique, qui contient l’ion acétate, est de 118,1°C.
Acétate Ion Poids moléculaire
Le poids moléculaire de l’ion acétate (C2H3O2) est de 59,04 g/mol, ce qui correspond à la somme des poids atomiques de tous les atomes de l’ion. Le poids moléculaire est utile pour déterminer la quantité de substance dans un échantillon.
| Apparence | Sans objet (ion) |
| Gravité spécifique | Sans objet (ion) |
| Couleur | Sans objet (ion) |
| Odeur | Sans objet (ion) |
| Masse molaire | 59,04 g/mole |
| Densité | Sans objet (ion) |
| Point de fusion | Sans objet (ion) |
| Point d’ébullition | Sans objet (ion) |
| Point d’éclair | Sans objet (ion) |
| Solubilité dans l’eau | Soluble dans l’eau |
| Solubilité | Soluble dans l’eau et les solvants polaires |
| La pression de vapeur | Sans objet (ion) |
| Densité de vapeur | Sans objet (ion) |
| pKa | 4,76 |
| pH | Acide |
Sécurité et dangers des ions acétate
L’ion acétate est généralement considéré comme sûr car il s’agit d’un ion présent naturellement dans de nombreux produits alimentaires et boissons. Cependant, les solutions concentrées d’ acide acétique , qui contiennent l’ion acétate, peuvent être nocives en cas d’ingestion, d’inhalation ou de contact avec la peau et les yeux, provoquant une irritation ou des brûlures chimiques. Un équipement de protection et une ventilation appropriés doivent être utilisés lors de la manipulation de solutions concentrées d’acide acétique.
| Symboles de danger | Irritant |
| Description de la sécurité | S2 – Tenir hors de portée des enfants. S26 – En cas de contact avec les yeux, rincer immédiatement et abondamment à l’eau et consulter un médecin. S37 – Porter des gants adaptés. S60 – Ce matériau et son contenant doivent être éliminés comme déchet dangereux. |
| Numéros d’identification de l’ONU | UN2790 |
| Code SH | 2915.90.90 |
| Classe de danger | 8 |
| Groupe d’emballage | III |
| Toxicité | L’ion acétate est considéré comme faiblement toxique lorsqu’il est ingéré, mais les solutions concentrées d’acide acétique (qui contiennent des ions acétate) peuvent être nocives en cas d’ingestion, d’inhalation ou de contact avec la peau et les yeux. |
Méthodes de synthèse d’ions acétate
La synthèse de l’ion acétate implique généralement la formation d’ acide acétique , qui est le composé parent qui contient l’ion acétate. Une méthode courante de synthèse de l’acide acétique implique l’oxydation de l’éthanol à l’aide d’un agent oxydant tel que l’acide chromique. Une autre méthode implique la carbonylation du méthanol à l’aide de monoxyde de carbone et d’un catalyseur. L’acide acétique peut également être produit biologiquement par la fermentation des glucides par des bactéries acétogènes. L’ion acétate peut également être obtenu par dissociation de l’acide acétique dans une solution, qui libère l’ion acétate et les ions hydrogène. Dans certains cas, l’ion acétate peut également être obtenu par la réaction d’un ester acétique avec une base forte.
Utilisations des ions acétate
L’ion acétate (C2H3O2), sous forme d’ acide acétique , sert à diverses fins dans toutes les industries. L’industrie alimentaire utilise l’acide acétique comme condiment et conservateur en raison de son goût aigre et de ses propriétés antimicrobiennes. L’industrie textile utilise l’acide acétique comme composant des assouplissants textiles et comme fixateur de teinture. Dans l’industrie chimique, l’acide acétique sert de matière première pour la production d’autres produits chimiques tels que l’acétate de vinyle, utilisé dans les adhésifs et les revêtements. L’industrie pharmaceutique utilise les ions acétate comme ingrédient dans les médicaments et comme tampon dans les traitements médicaux. De plus, l’acétate de cellulose, un type de plastique, est produit à partir d’acide acétique et trouve des applications dans les films et les fibres optiques.
