L’octane est un carburant à indice d’octane élevé utilisé dans les moteurs à combustion. Il améliore les performances du moteur, réduit les cognements et augmente la puissance de sortie. Il est couramment utilisé dans les véhicules hautes performances et les voitures de course.
| Nom UICPA | Octane |
| Formule moléculaire | C8H18 |
| Numero CAS | 111-65-9 |
| Synonymes | n-Octane, Octane normal, Octane |
| InChI | InChI=1S/C8H18/c1-3-5-7-8-6-4-2/h3-8H2,1-2H3 |
Propriétés d’octane
Formule d’octane
La formule de l’octane est C8H18. Il se compose de huit atomes de carbone et de dix-huit atomes d’hydrogène. Cette formule moléculaire représente la disposition des atomes dans une seule molécule d’octane.
Octane Masse molaire
La masse molaire de l’octan est calculée en additionnant les masses atomiques de tous les atomes dans sa formule chimique. La masse molaire de l’octan est d’environ 114,22 grammes par mole. C’est important dans divers calculs impliquant la quantité d’octane dans un échantillon donné.
Point d’ébullition de l’indice d’octane
Octan a un point d’ébullition d’environ 125,5 degrés Celsius (257,9 degrés Fahrenheit). Il s’agit de la température à laquelle l’octan passe d’une phase liquide à une phase gazeuse. Le point d’ébullition de l’octan est influencé par sa structure moléculaire et ses forces intermoléculaires.
Point de fusion de l’indice d’octane
Octan a un point de fusion d’environ -57 degrés Celsius (-70,6 degrés Fahrenheit). C’est la température à laquelle l’octan passe de l’état solide à l’état liquide. Le point de fusion de l’octan dépend de facteurs tels que la structure moléculaire et les forces intermoléculaires.
Densité d’octane g/mL
La densité de l’octan est d’environ 0,703 grammes par millilitre (g/mL). La densité est une mesure de la masse par unité de volume d’une substance. La densité de l’octane est inférieure à celle de l’eau, qui a une densité de 1 g/mL, ce qui indique que l’octane est moins dense que l’eau.
Octane Poids moléculaire
Le poids moléculaire de l’octane est d’environ 114,22 grammes par mole. C’est la somme des poids atomiques de tous les atomes d’une molécule d’octan. Le poids moléculaire est crucial dans divers calculs, tels que la détermination de la quantité d’octane nécessaire dans une réaction.
Structure d’octane
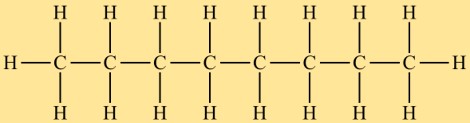
L’octan appartient à la classe des alcanes et possède une structure linéaire. Il se compose d’une chaîne de huit atomes de carbone auxquels sont attachés des atomes d’hydrogène. La disposition des atomes dans l’octan est telle qu’il n’y a aucune structure ramifiée ou cyclique.
Solubilité de l’indice d’octane
L’octan est considéré comme insoluble dans l’eau. Il présente une faible solubilité dans les solvants polaires en raison de sa nature non polaire. Cependant, l’octane est hautement soluble dans les solvants non polaires, tels que d’autres hydrocarbures, huiles et solvants organiques.
| Apparence | Liquide incolore |
| Gravité spécifique | 0,703 g/ml |
| Couleur | Incolore |
| Odeur | Inodore |
| Masse molaire | 114,22 g/mole |
| Densité | 0,703 g/ml |
| Point de fusion | -57 °C (-70,6 °F) |
| Point d’ébullition | 125,5 °C (257,9 °F) |
| Point d’éclair | -18 °C (0 °F) |
| Solubilité dans l’eau | Insoluble |
| Solubilité | Soluble dans les solvants non polaires |
| La pression de vapeur | 12,9 mmHg à 20 °C |
| Densité de vapeur | 3,47 (air = 1) |
| pKa | ~ 45 |
| pH | Neutre |
Sécurité et dangers d’Octane
Octan présente certains risques pour la sécurité qui doivent être pris en compte. Il est hautement inflammable et peut s’enflammer facilement, ce qui présente un risque d’incendie. Les vapeurs d’octan peuvent former des mélanges explosifs avec l’air, ce qui augmente le risque d’incendies et d’explosions. Il est important de manipuler l’octan avec prudence, en assurant une ventilation adéquate et en évitant les sources d’inflammation. Le contact cutané avec l’octan peut provoquer une irritation et une sécheresse. L’ingestion ou l’inhalation d’octan peut entraîner des risques pour la santé, notamment une irritation respiratoire et des effets sur le système nerveux central. Il est essentiel de suivre les consignes de sécurité, d’utiliser un équipement de protection individuelle approprié et de conserver l’octan à l’écart des substances incompatibles.
| Symboles de danger | Inflammable (F), Irritant (Xi) |
| Description de la sécurité | Tenir à l’écart de la chaleur/des étincelles/des flammes nues. Utiliser dans un endroit bien ventilé. Évitez tout contact avec la peau et les yeux. |
| Numéros d’identification de l’ONU | ONU 1262 |
| Code SH | 2901.10.10 |
| Classe de danger | 3 – Liquides inflammables |
| Groupe d’emballage | III |
| Toxicité | Faible |
Méthodes de synthèse d’octane
Diverses méthodes peuvent synthétiser l’octan. Une méthode courante consiste à reformer catalytiquement des fractions pétrolières comme le naphta. Le processus chauffe le naphta et le fait passer sur un catalyseur, généralement du platine ou du rhénium, favorisant le réarrangement des molécules d’hydrocarbures. Ce réarrangement produit des composés à indice d’octan plus élevé, notamment l’octan.
Une autre méthode consiste à alkyler l’isobutane avec des butènes. L’acide sulfurique ou acide fluorhydrique , agissant comme catalyseurs acides, facilite la réaction de l’isobutane, un hydrocarbure ramifié, avec des hydrocarbures insaturés (butènes). Cette réaction forme des molécules d’octane à chaîne ramifiée.
Une isomérisation est une approche supplémentaire pour produire de l’octan. Il convertit les hydrocarbures à chaîne droite comme l’hexane ou l’heptane en isomères à chaîne ramifiée. Divers catalyseurs, notamment des zéolites ou des catalyseurs à base de platine, peuvent catalyser ce processus.
De plus, l’octane peut être obtenu en hydrogénant des hydrocarbures aromatiques comme le toluène ou le xylène en utilisant de l’hydrogène gazeux et un catalyseur approprié. Cette réaction convertit les composés aromatiques en cyclohexane, qui peut être davantage déshydrogéné pour produire de l’octane.
Ces méthodes de synthèse jouent un rôle important dans la production d’octane, largement utilisé comme composant carburant dans l’essence. L’utilisation de ces techniques permet d’obtenir un octan avec l’indice d’octan souhaité, garantissant des performances et une efficacité optimales dans les moteurs à combustion.
Utilisations de l’octane
Octan trouve diverses utilisations dans différentes industries en raison de ses propriétés bénéfiques. Voici quelques applications clés de l’octan :
- Carburant : l’octan est principalement utilisé comme composant carburant dans l’essence. Il améliore l’indice d’octane du carburant, ce qui améliore les performances du moteur, réduit les cognements et prévient les dommages au moteur. C’est particulièrement important dans les véhicules hautes performances et les voitures de course.
- Moteurs à combustion : Octan est crucial pour les moteurs à combustion interne, y compris ceux des voitures, des motos et des petits moteurs. Il fournit la source d’énergie nécessaire au fonctionnement et à la propulsion des véhicules et des machines.
- Synthèse chimique : Octan sert de précurseur pour la production de divers produits chimiques. Il est utilisé comme matière première pour la synthèse d’autres composés hydrocarbonés, tels que les alcools, les aldéhydes et les acides.
- Solvant de laboratoire : Octan est utilisé comme solvant non polaire dans les laboratoires. Sa faible polarité le rend adapté à la dissolution de composés apolaires, permettant aux chercheurs de réaliser certaines expériences et extractions.
- Référence standard : pour déterminer les indices d’octan et comparer les performances de différents carburants, les chercheurs et les experts utilisent activement l’octan comme composé de référence et de référence. Il aide à établir des normes pour la qualité et l’efficacité de l’essence et d’autres carburants à base d’hydrocarbures.
- Étalonnage : Octan est utilisé dans l’étalonnage d’équipements, tels que les chromatographes en phase gazeuse, pour garantir des mesures exactes et précises. Ses propriétés connues et son comportement bien caractérisé en font un étalon d’étalonnage fiable.
- Recherche et développement : Octan est essentiel à des fins de recherche et de développement dans les industries de l’automobile et des carburants. Les scientifiques et les ingénieurs étudient activement les propriétés, les caractéristiques de combustion et l’impact environnemental de l’octan pour améliorer le rendement énergétique, réduire les émissions et innover en matière de carburants alternatifs.
Octan alimente activement les transports, permet la synthèse chimique, facilite le travail en laboratoire et stimule les progrès dans les secteurs de l’automobile et de l’énergie.
Des questions:
Q : Quel composé a le point de fusion le plus élevé ?
R : Al2(CO3)3.
Q : Quelle est l’enthalpie standard de formation de cet isomère du C8H18(g) ?
R : L’enthalpie standard de formation de l’isomère C8H18(g) est spécifique à l’isomère particulier et nécessiterait son identification pour déterminer la valeur.
Q : Quelle est la masse en grammes de 5,90 moles de C8H18 ?
R : La masse de 5,90 moles de C8H18 est d’environ 789,26 grammes.
Q : Quelle affirmation compare le mieux le point de fusion du butane (C4H10) à celui de l’octane (C8H18) ?
R : L’octan (C8H18) a un point de fusion plus élevé que le butane (C4H10).
Q : Quel est le nom de C8H18 ?
R : Le nom de C8H18 est octan.
Q : Qu’est-ce que l’octane ?
R : L’octane est un hydrocarbure alcane de formule moléculaire C8H18. Il est couramment utilisé comme composant combustible dans l’essence.
Q : Quel est l’indice d’octane de l’essence ?
R : L’indice d’octane de l’essence fait référence à sa capacité à résister aux cognements pendant la combustion. Il indique les propriétés antidétonantes du carburant et son adéquation aux moteurs à haute compression.
Q : Qu’est-ce que l’indice d’octane et l’indice de cétane ?
R : L’indice d’octane mesure les propriétés antidétonantes de l’essence, tandis que l’indice de cétane mesure la qualité d’inflammation du carburant diesel.
Q : Qu’est-ce que l’indice d’octane ?
R : L’indice Octan est une valeur numérique qui représente la performance d’un carburant en matière de résistance aux cognements pendant la combustion. Il indique la capacité du carburant à résister à la compression avant l’allumage.
Q : Quel est le nom de l’hydrocarbure CH3(CH2)6CH3 ?
R : Le nom de l’hydrocarbure CH3(CH2)6CH3 est octane.
