Titanium oksida, juga dikenal sebagai titanium dioksida, adalah pigmen putih alami yang biasa digunakan dalam cat, pelapis, plastik, dan tabir surya. Ia memiliki indeks bias dan opacity yang tinggi.
| Nama IUPAC | Titanium(IV)oksida |
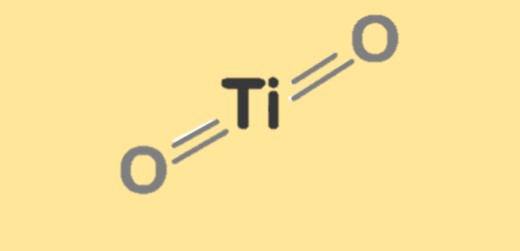
| Formula molekul | TiO2 |
| nomor CAS | 13463-67-7 |
| Sinonim | Titanium dioksida, titanium, anatase, brookite, rutil, saringan molekuler oktahedral (OMS), E171 |
| Di ChI | InChI=1S/2O.Ti |
| InChIKey=ZQIUJXQCIJLZJK-UHFFFAOYSA-N |
Sifat titanium dioksida
Massa molar Titanium Oksida
Massa molar titanium oksida (TiO2) kira-kira 79,87 g/mol. Ini adalah bubuk putih, tidak berbau dan tidak berasa, tidak larut dalam air dan pelarut organik. Massa molar dihitung dengan menjumlahkan massa atom satu atom titanium dan dua atom oksigen yang membentuk satu molekul TiO2. Nilai ini penting untuk menentukan stoikiometri reaksi kimia yang melibatkan titanium oksida.
Titik didih titanium oksida
Titanium oksida tidak memiliki titik didih yang jelas karena ia terurai sebelum mencapai titik lelehnya. Temperatur dekomposisi TiO2 bergantung pada struktur kristal, ukuran partikel dan kemurnian material. Misalnya, TiO2 rutil terurai pada suhu sekitar 1850°C, sedangkan TiO2 anatase terurai pada suhu lebih rendah, sekitar 1600°C. Pada suhu yang lebih tinggi, titanium oksida direduksi menjadi logam titanium. Properti ini menjadikannya bahan yang berguna dalam aplikasi suhu tinggi, seperti pelapis tungku dan batu bata tahan api.
Titik lebur titanium oksida
Titik leleh titanium oksida bergantung pada struktur kristalnya. TiO2 Anatase memiliki titik leleh sekitar 1550°C, sedangkan TiO2 rutil memiliki titik leleh lebih tinggi sekitar 1850°C. Titik leleh TiO2 juga dipengaruhi oleh pengotor yang ada pada material, seperti besi dan logam transisi lainnya, yang dapat menurunkan titik leleh dan mengubah struktur kristal. Pada suhu tinggi, titanium oksida dapat mengalami reduksi membentuk logam titanium.
Kepadatan titanium oksida g/ml
Kepadatan titanium oksida bergantung pada struktur kristal dan ukuran partikel. TiO2 anatase memiliki densitas sebesar 3,78 g/cm3, sedangkan TiO2 rutil memiliki densitas lebih tinggi yaitu 4,23 g/cm3. Pengotor yang ada dalam material mempengaruhi struktur kristal TiO2 dan dapat mengubah kepadatan pengepakan partikelnya, sehingga mempengaruhi kepadatannya. Dibandingkan dengan oksida logam lainnya, titanium oksida memiliki kepadatan yang rendah, menjadikannya bahan yang berguna dalam aplikasi yang menginginkan rasio berat terhadap volume yang rendah.
Berat molekul titanium oksida
Berat molekul titanium oksida (TiO2) adalah sekitar 79,87 g/mol. Ini adalah senyawa yang terdiri dari satu atom titanium dan dua atom oksigen. Berat molekul penting dalam menentukan stoikiometri reaksi kimia yang melibatkan titanium oksida, serta sifat fisik dan kimianya.
Struktur titanium dioksida
Titanium dioksida memiliki tiga struktur kristal utama: rutil, anatase, dan brookite. Rutil adalah yang paling stabil dan memiliki struktur kristal tetragonal, sedangkan anatase memiliki struktur tetragonal yang lebih terbuka dan terdistorsi. Brookite memiliki struktur kristal ortorombik. Struktur kristal titanium dioksida mempengaruhi sifat fisik dan kimianya, seperti densitas, titik leleh, dan reaktivitasnya. Struktur titanium dioksida dapat dimodifikasi dengan doping dengan logam lain atau dengan mengubah kondisi sintesis, sehingga menghasilkan bahan dengan sifat dan aplikasi unik.
Rumus Titanium Dioksida
Rumus kimia titanium dioksida adalah TiO2, yang menunjukkan bahwa setiap molekul TiO2 mengandung satu atom titanium dan dua atom oksigen. Rumusnya penting untuk menentukan stoikiometri reaksi kimia yang melibatkan titanium dioksida, serta sifat fisik dan kimianya. Rumusnya juga dapat digunakan untuk menghitung jumlah titanium dioksida yang dibutuhkan dalam aplikasi tertentu, seperti dalam produksi pigmen, pelapis, dan keramik.
| Penampilan | bubuk putih |
| Berat jenis | 3.9 – 4.25 |
| Warna | Putih |
| Bau | Tidak berbau |
| Masa molar | 79,87 g/mol |
| Kepadatan | 3,78 – 4,23 gram/cm3 |
| Titik fusi | 1550°C (anatase) – 1850°C (rutil) |
| Titik didih | Rusak sebelum direbus |
| Titik kilat | Tak dapat diterapkan |
| Kelarutan dalam air | Tidak larut |
| Kelarutan | Tidak larut dalam air dan pelarut organik |
| Tekanan uap | Tak dapat diterapkan |
| Kepadatan uap | Tak dapat diterapkan |
| pKa | Tak dapat diterapkan |
| pH | 6.5 – 8.5 |
Apakah titanium dioksida aman?
Titanium dioksida umumnya dianggap aman dan tidak beracun. Itu tidak mudah terbakar, meledak atau reaktif dengan bahan kimia lainnya. Namun, seperti partikel halus lainnya, partikel ini dapat menyebabkan iritasi pernapasan jika terhirup dalam konsentrasi tinggi, yang dapat menyebabkan batuk, sesak dada, dan sesak napas. Paparan debu tingkat tinggi dalam waktu lama juga dapat menyebabkan kerusakan paru-paru. Penting untuk menangani titanium dioksida di tempat yang berventilasi baik dan mengenakan alat pelindung diri yang sesuai, seperti masker debu, saat menangani titanium dioksida dalam jumlah besar. Selain itu, titanium dioksida yang tertelan atau terkena mata secara tidak sengaja harus dihindari.
| Simbol bahaya | Tidak ada |
| Deskripsi Keamanan | Tidak dianggap berbahaya dalam kondisi penggunaan normal |
| Nomor identifikasi PBB | Tak dapat diterapkan |
| kode HS | 28230000 |
| Kelas bahaya | Tidak tergolong berbahaya |
| Kelompok pengepakan | Tak dapat diterapkan |
| Toksisitas | Secara umum dianggap tidak beracun, namun dapat menyebabkan iritasi pernapasan jika terhirup dalam konsentrasi tinggi. |
Metode untuk mensintesis titanium oksida
Titanium oksida dapat disintesis dengan beberapa metode, termasuk proses kimia dan fisik. Metode yang paling umum adalah:
- Proses sulfat mereaksikan bijih titanium dengan asam sulfat untuk menghasilkan bentuk titanium dioksida terhidrasi, yang mengalami kalsinasi pada suhu tinggi untuk mendapatkan produk akhir.
- Proses klorida melibatkan reaksi bijih titanium dengan gas klor untuk membentuk titanium tetraklorida, yang kemudian mengalami hidrolisis untuk menghasilkan titanium dioksida.
- Pada metode sol-gel, hidrolisis titanium alkoksida dalam larutan dilanjutkan dengan reaksi kondensasi yang membentuk gel. Kemudian gel mengalami pengeringan dan kalsinasi untuk menghasilkan titanium oksida.
- Proses sintesis api menghasilkan partikel titanium oksida dengan membakar bahan bakar dan oksidator dalam nyala api untuk menghasilkan aliran gas bersuhu tinggi. Prekursor titanium disuntikkan ke dalam nyala api, lalu bereaksi dan membentuk partikel.
- Dalam metode sintesis hidrotermal, prekursor titanium mengalami pelarutan dalam larutan berair pada suhu tinggi dan tekanan tinggi, yang mendorong pertumbuhan kristal titanium oksida.
Pilihan metode bergantung pada sifat yang diinginkan dari produk titanium oksida, serta biaya dan kelayakan proses. Setiap metode memiliki kelebihan dan keterbatasannya masing-masing, dan para peneliti terus mengeksplorasi metode baru untuk mensintesis titanium oksida dengan sifat dan kinerja yang lebih baik.
Untuk apa titanium dioksida digunakan?
Titanium oksida memiliki beragam aplikasi karena sifatnya yang unik, termasuk indeks biasnya yang tinggi, opasitasnya yang tinggi, dan ketahanannya terhadap sinar UV yang sangat baik. Beberapa kegunaan paling umum dari titanium oksida adalah:
- Industri pigmen banyak menggunakan titanium dioksida dalam cat, pelapis, plastik, dan kertas karena menawarkan opasitas, kecerahan, dan ketahanan UV yang tinggi, menjadikannya pilihan populer untuk aplikasi eksterior.
- Produsen umumnya menggunakan titanium dioksida dalam tabir surya dan produk kosmetik lainnya sebagai penyerap UV yang efektif untuk melindungi kulit dari sinar UV.
- Produksi bahan keramik, termasuk keramik listrik, konverter katalitik, dan glasir keramik, sangat bergantung pada titanium dioksida sebagai komponen utamanya.
- Dalam berbagai reaksi kimia, termasuk produksi polietilen dan polimer lainnya, titanium dioksida bertindak sebagai katalis.
- Industri elektronik menggunakan titanium dioksida dalam produksi perangkat elektronik, seperti kapasitor dan resistor, karena konstanta dielektriknya yang tinggi dan konduktivitas listrik yang rendah.
- Untuk meningkatkan reflektifitas dan daya tahannya, produsen mengaplikasikan lapisan tipis titanium dioksida pada lensa, cermin, dan komponen optik lainnya, yang banyak digunakan dalam industri pelapis optik.
- Karena biokompatibilitas dan ketahanan korosinya yang sangat baik, implan medis, seperti implan gigi, menggunakan titanium dioksida dalam aplikasi biomedis.
Keberagaman aplikasi titanium oksida menyoroti pentingnya titanium oksida di berbagai industri dan potensinya untuk inovasi masa depan.
Pertanyaan: Titanium dioksida dalam makanan
Titanium dioksida merupakan bahan tambahan makanan yang biasa digunakan untuk memutihkan dan mencerahkan produk makanan. Label bahan produk makanan sering kali mencantumkannya sebagai E171 atau “titanium dioksida”. Ini disetujui sebagai pewarna makanan di Amerika Serikat, Uni Eropa dan banyak negara lainnya. Produsen menggunakannya untuk memberikan tampilan putih berkilau dan untuk meningkatkan tekstur dan konsistensi produk makanan, termasuk permen, permen karet, makanan yang dipanggang, produk susu, dan minuman. Selain itu, digunakan sebagai zat penyebar cahaya untuk meningkatkan opasitas produk makanan tertentu.
Meskipun titanium dioksida umumnya dianggap aman untuk digunakan dalam makanan, ada kekhawatiran bahwa mengonsumsinya dalam jumlah banyak dapat membahayakan. Studi menunjukkan bahwa nanopartikel titanium dioksida dapat menimbulkan efek toksik pada kesehatan manusia, khususnya pada sistem pencernaan. Namun, diperlukan lebih banyak penelitian untuk mengetahui keamanan titanium dioksida dalam makanan.
Beberapa negara telah mengambil langkah-langkah untuk membatasi penggunaan titanium dioksida dalam makanan. Misalnya, Prancis melarang penggunaan titanium dioksida sebagai bahan tambahan makanan pada tahun 2020, dan Uni Eropa saat ini sedang meninjau keamanan titanium dioksida dalam makanan. Konsumen harus menyadari potensi risiko dan manfaat titanium dioksida, seperti halnya bahan tambahan makanan lainnya, dan membuat pilihan yang tepat mengenai makanan yang mereka konsumsi.
