Tetrafluoroethylene atau C2F4 adalah gas tidak berwarna dan tidak berbau yang digunakan dalam produksi fluoropolimer seperti Teflon. Ini juga digunakan dalam produksi zat pendingin dan propelan.
| Nama IUPAC | Tetrafluoroetilen |
| Formula molekul | C2F4 |
| nomor CAS | 116-14-3 |
| Sinonim | TFE, perfluoroetilen, etena, tetrafluoro-, F4E, freon 1113, halokarbon 1113 |
| Di ChI | InChI=1S/C2F4/c3-1(4)2(5)6 |
Struktur Lewis C2F4
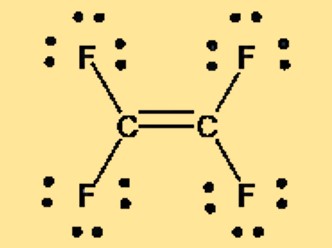
Struktur Lewis tetrafluoroetilen, juga dikenal sebagai TFE atau C2F4, dapat diwakili oleh dua atom karbon yang terikat ganda satu sama lain, dengan masing-masing atom karbon terikat pada dua atom fluor. Struktur Lewis menunjukkan susunan elektron valensi dalam molekul dan memberikan informasi tentang ikatan dan geometri molekul. Sifat nonpolar TFE juga terlihat pada struktur Lewisnya, yang tidak menunjukkan pemisahan muatan atau momen dipol bersih.
Massa molar tetrafluoroetilen
Massa molar tetrafluoroetilen, juga disebut TFE atau C2F4, adalah 100,02 g/mol. Nilai ini dihitung dengan menjumlahkan massa atom seluruh unsur yang ada dalam molekul, yaitu dua atom karbon dan empat atom fluor. Massa molar merupakan parameter penting dalam menentukan jumlah suatu zat yang ada dalam volume atau massa tertentu dan juga digunakan dalam perhitungan stoikiometri.
Titik didih tetrafluoroetilen
Tetrafluoroetilen memiliki titik didih -76,3°C (-105,34°F) pada tekanan standar. Ini adalah gas yang sangat mudah menguap yang dapat menguap dengan cepat pada suhu kamar dan tekanan atmosfer. Titik didih TFE yang rendah membuatnya ideal untuk berbagai aplikasi industri seperti sistem pendingin dan sebagai propelan untuk aerosol.
Titik lebur tetrafluoroetilen
Tetrafluoroetilen tidak memiliki titik leleh yang jelas karena ia mengalami transisi fase langsung dari padat ke gas, melewati fase cair. Namun, bentuk padat TFE dapat berada pada suhu di bawah -76,3°C dalam kondisi tekanan tinggi. Bentuk padat TFE juga sangat tidak stabil dan reaktif serta dapat berpolimerisasi atau terurai secara spontan.
Massa jenis tetrafluoroetilen g/ml
Massa jenis tetrafluoroetilen pada suhu dan tekanan standar (STP) adalah 1,47 g/L. Namun, karena TFE berbentuk gas, densitasnya dapat bervariasi secara signifikan seiring dengan perubahan suhu dan tekanan. Pada suhu kamar dan tekanan atmosfer, densitas TFE kira-kira 3,21 g/L.
Berat molekul tetrafluoroetilen
Berat molekul C2F4 adalah 100,02 g/mol. Nilai ini dihitung dengan menjumlahkan berat atom semua atom yang ada dalam molekul. TFE memiliki berat molekul yang relatif rendah, sehingga menyebabkan volatilitas yang tinggi dan titik didih yang rendah.
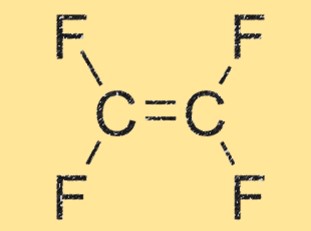
struktur C2F4
C2F4 memiliki struktur linier, dengan dua atom karbon terikat ganda satu sama lain dan masing-masing terikat pada dua atom fluor. Molekulnya sangat simetris dan tidak mempunyai momen dipol bersih, menjadikannya nonpolar. Geometri linier TFE juga berkontribusi terhadap reaktivitas tinggi dan kemampuannya membentuk rantai polimer.
Rumus C2F4
Rumus kimia C2F4 adalah C2F4, yang menunjukkan bahwa molekul tersebut mengandung dua atom karbon dan empat atom fluor. Rumusnya memberikan informasi tentang jenis dan jumlah atom yang ada dalam molekul, yang berguna dalam memprediksi perilaku dan reaksi kimianya.
| Penampilan | Gas tidak berwarna |
| Berat jenis | 1,47 g/L pada STP |
| Warna | Tanpa warna |
| Bau | Tidak berbau |
| Masa molar | 100,02 g/mol |
| Kepadatan | 3,21 g/L pada suhu kamar dan tekanan atmosfer |
| Titik fusi | Tidak memiliki titik leleh yang jelas |
| Titik didih | -76,3°C (-105,34°F) pada tekanan standar |
| Titik kilat | Tidak berlaku karena TFE berbentuk gas |
| Kelarutan dalam air | Tidak larut |
| Kelarutan | Larut dalam beberapa pelarut organik seperti aseton dan kloroform |
| Tekanan uap | 209,7 kPa pada 20°C |
| Kepadatan uap | 2,95 (udara = 1) |
| pKa | Tidak berlaku, karena TFE bukanlah asam atau basa |
| pH | Tidak berlaku, karena TFE bukanlah asam atau basa |
Keamanan dan bahaya tetrafluoroetilen
Tetrafluoroetilen dapat menimbulkan beberapa risiko keselamatan dan kesehatan jika tidak ditangani dengan benar. Paparan TFE konsentrasi tinggi dapat menyebabkan iritasi pada mata, kulit, dan saluran pernapasan. Paparan yang terlalu lama juga dapat menyebabkan kerusakan paru-paru, termasuk edema paru dan pneumonia. TFE juga merupakan gas mudah terbakar yang dapat membentuk campuran yang mudah meledak dengan udara. Oleh karena itu, harus disimpan dan diangkut dalam wadah khusus untuk menghindari risiko kebakaran atau ledakan. Penting untuk menggunakan peralatan pelindung yang sesuai, termasuk pelindung pernapasan, saat menangani TFE untuk mencegah paparan dan meminimalkan risiko dampak buruk terhadap kesehatan.
| Simbol bahaya | F+ (sangat mudah terbakar) |
| Deskripsi Keamanan | Gas yang sangat mudah terbakar. Menyebabkan iritasi mata yang serius. Dapat menyebabkan iritasi pernafasan. |
| Nomor identifikasi PBB | UN1080 |
| kode HS | 2903.39 |
| Kelas bahaya | 2.1 (Gas yang mudah terbakar) |
| Kelompok pengepakan | Tidak berlaku karena TFE berbentuk gas |
| Toksisitas | TFE memiliki toksisitas akut yang rendah, namun paparan yang terlalu lama dapat menyebabkan kerusakan paru-paru dan dampak buruk lainnya terhadap kesehatan. TFE juga dianggap berpotensi menyebabkan kanker pada manusia. |
Metode sintesis tetrafluoroetilen
Tetrafluoroethylene (TFE) dapat disintesis dengan beberapa metode, termasuk dekomposisi termal dan katalitik berbagai senyawa fluorokarbon.
Metode umum untuk mensintesis TFE adalah dekomposisi termal klorodifluorometana (CCl2F2) dengan adanya inisiator yang sesuai pada suhu tinggi. Prosesnya melibatkan pemutusan ikatan karbon-klorin pada CCl2F2 untuk membentuk radikal, yang kemudian bereaksi dengan molekul lain menghasilkan TFE.
Metode lain adalah dekomposisi katalitik senyawa fluorokarbon seperti hexafluoropropene (HFP) atau octafluorocyclobutane (OFCB) dengan katalis yang sesuai, seperti aluminium klorida atau antimon pentafluorida, pada suhu tinggi. Metode ini menghasilkan campuran TFE dan produk samping fluorokarbon lainnya, yang kemudian dipisahkan dan dimurnikan.
Selain itu, TFE dapat disintesis melalui fluorinasi elektrokimia, suatu proses yang melibatkan melewatkan campuran gas hidrogen dan fluor melalui anoda logam dengan adanya elektrolit. Metode ini menghasilkan campuran TFE dan senyawa berfluorinasi lainnya, yang kemudian dipisahkan dan dimurnikan.
Secara keseluruhan, sintesis TFE memerlukan peralatan dan keahlian khusus karena sifat bahan kimia yang sangat reaktif dan berbahaya. Oleh karena itu, penting untuk mengikuti protokol dan peraturan keselamatan yang tepat saat mensintesis TFE.
Kegunaan tetrafluoroetilen
Tetrafluoroethylene (TFE) adalah bahan kimia serbaguna dengan beberapa aplikasi industri dan komersial.
- Salah satu kegunaan utama TFE adalah sebagai monomer untuk produksi polytetrafluoroethylene (PTFE), polimer anti lengket dan tahan panas yang biasa dikenal dengan Teflon.
- TFE berfungsi sebagai bahan mentah untuk menghasilkan senyawa berfluorinasi lainnya, seperti asam karboksilat perfluorinasi dan perfluoroalkil sulfonat, yang dapat diterapkan dalam bidang elektronik, tekstil, dan industri lainnya.
- TFE memainkan peran penting dalam produksi fluoropolimer, seperti polivinilidena fluorida (PVDF), yang banyak digunakan dalam pelapis, pipa, dan kabel karena ketahanan dan ketahanan kimianya yang tinggi.
- Produsen menggunakan TFE sebagai bahan pendingin dalam sistem pendingin udara dan pendingin serta dalam produksi bahan insulasi busa.
- Industri farmasi menggunakan TFE sebagai pelarut dan propelan untuk formulasi aerosol.
- TFE memiliki banyak aplikasi, termasuk pelapis peralatan masak, insulasi listrik, dan gasket berperforma tinggi.
Secara keseluruhan, keserbagunaan dan sifat unik TFE menjadikannya bahan kimia yang berharga dalam berbagai aplikasi industri dan komersial. Namun, penting untuk mengikuti protokol dan peraturan keselamatan yang tepat saat menangani TFE untuk meminimalkan risiko dampak buruk terhadap kesehatan dan kerusakan lingkungan.
Pertanyaan:
Orbital atom atau hibrid manakah yang membentuk ikatan sigma antara c2 dan f dalam tetrafluoroetilen, c2f4?
Ikatan sigma antara C2 dan F dalam tetrafluoroetilen (C2F4) dibentuk oleh tumpang tindih orbital hibrid. Pada C2F4, setiap atom karbon mengalami hibridisasi sp2, artinya tiga orbital atomnya (satu orbital 2s dan dua orbital 2p) bergabung membentuk tiga orbital hibridisasi sp2, tersusun dalam geometri trigonal planar. Setiap atom karbon juga memiliki orbital 2p yang tidak terhibridisasi, tegak lurus terhadap bidang orbital sp2.
Atom fluor memiliki orbital 2p yang terisi tunggal yang tumpang tindih dengan orbital 2p yang tidak terhibridisasi dari atom karbon yang berdekatan untuk membentuk ikatan sigma. Tumpang tindih ini terjadi ujung ke ujung antara dua atom, sehingga menghasilkan susunan atom yang linier dalam molekul. Elektron dalam ikatan sigma terutama terletak di daerah antara dua inti, sehingga menciptakan ikatan kovalen yang kuat antara atom karbon dan fluor.
Teflon dihasilkan dari tetrafluoroetilen terpolimerisasi?
Ya, Teflon diproduksi melalui polimerisasi tetrafluoroetilen (TFE). TFE adalah gas tidak berwarna dan tidak berbau yang dapat dipolimerisasi dengan adanya katalis untuk membentuk polytetrafluoroethylene (PTFE), yang biasa dikenal dengan Teflon.
Proses polimerisasi melibatkan permulaan reaksi menggunakan inisiator radikal bebas seperti amonium persulfat atau azobisisobutyronitrile (AIBN), yang menghasilkan radikal bebas yang memulai reaksi berantai monomer TFE yang dipolimerisasi menjadi PTFE.
