Tembaga iodida (CuI) adalah senyawa kimia berwarna kuning cerah. Ini terbentuk ketika tembaga bereaksi dengan yodium dan digunakan dalam berbagai aplikasi termasuk sintesis organik dan katalisis.
| Nama IUPAC | Tembaga(I)iodida |
| Formula molekul | CuI |
| nomor CAS | 7681-65-4 |
| Sinonim | Tembaga iodida, tembaga monoiodida, tembaga iodida (1:1) |
| Di ChI | InChI=1S/Cu.HI/h;1H/q+1;/p-1 |
Sifat tembaga iodida
Rumus Tembaga Iodida
Rumus kimia kupro iodida adalah CuI. Hal ini menunjukkan bahwa setiap unit kupro iodida terdiri dari satu atom tembaga (Cu) dan satu atom yodium (I). Rumus sederhana ini mewakili stoikiometri senyawa.
Massa Molar Tembaga Iodida
Massa molar kupro iodida (CuI) dapat dihitung dengan menjumlahkan massa atom unsur-unsur penyusunnya. Tembaga memiliki massa molar sekitar 63,55 g/mol, sedangkan yodium memiliki massa molar sekitar 126,90 g/mol. Jadi, massa molar CuI kira-kira 190,45 g/mol.
Titik didih tembaga iodida
Cuprous iodida tidak memiliki titik didih yang jelas karena ia mengalami dekomposisi sebelum mencapai titik didihnya. Saat dipanaskan, ia terurai menjadi logam tembaga dan gas yodium, sehingga tidak cocok untuk penentuan titik didih tradisional.
Titik Lebur Tembaga Iodida
Titik leleh kupro iodida relatif rendah dibandingkan dengan banyak logam halida lainnya. Titik lelehnya sekitar 606 derajat Celcius (1.123 derajat Fahrenheit). Pada suhu ini, iodida tembaga padat berubah menjadi cairan cair.
Massa jenis tembaga iodida g/mL
Tembaga iodida memiliki kepadatan sekitar 5,67 g/mL. Nilai ini mewakili massa kupro iodida per satuan volume. Hal ini menunjukkan bahwa kupro iodida relatif padat dibandingkan dengan beberapa senyawa anorganik lainnya.
Berat Molekul Tembaga Iodida
Berat molekul kupro iodida, juga disebut massa molar, kira-kira 190,45 g/mol. Ini adalah jumlah berat atom semua atom yang ada dalam molekul kupro iodida (CuI).
Struktur tembaga iodida
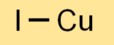
Cuprous iodida terdapat dalam berbagai struktur kristal, termasuk fase alfa, beta, dan gamma. Bentuk paling umum adalah fase alfa, yang memiliki struktur campuran seng. Ini membentuk jaringan atom tembaga dan yodium.
Kelarutan tembaga iodida
Kelarutan kupro iodida dalam berbagai pelarut berbeda-beda. Ia sulit larut dalam air dan kelarutannya dapat ditingkatkan dengan menambahkan ion iodida. Pelarut organik seperti etanol dapat melarutkannya lebih efektif dibandingkan air.
| Penampilan | Padat berwarna kuning cerah |
| Berat jenis | 5,67 gram/ml |
| Warna | KUNING |
| Bau | Tidak berbau |
| Masa molar | 190,45 g/mol |
| Kepadatan | 5,67 gram/cm³ |
| Titik fusi | 606°C (1123°F) |
| Titik didih | Rusak sebelum direbus |
| Titik kilat | Tak dapat diterapkan |
| Kelarutan dalam air | Sulit larut |
| Kelarutan | Larut dalam pelarut organik seperti etanol dan eter |
| Tekanan uap | Tidak tersedia |
| Kepadatan uap | Tidak tersedia |
| pKa | Tidak tersedia |
| pH | Tak dapat diterapkan |
Harap dicatat bahwa beberapa sifat, seperti titik nyala, tekanan uap, kepadatan uap, pKa dan pH, tidak berlaku atau tersedia untuk kupro iodida karena sifat dan sifat-sifatnya.
Keamanan dan Bahaya Tembaga Iodida
Cuprous iodide menimbulkan risiko keamanan tertentu yang harus dipertimbangkan saat menangani. Penting untuk mengenakan alat pelindung diri (APD) yang sesuai seperti sarung tangan dan kacamata untuk menghindari kontak dengan kulit dan mata. Menghirup debu atau asap harus dihindari karena dapat menyebabkan iritasi pernafasan. Cuprous iodide cukup beracun jika tertelan dan tidak boleh dikonsumsi. Selain itu, penting untuk bekerja dengan tembaga iodida di area yang berventilasi baik untuk menghindari penumpukan uap. Penyimpanan yang tepat dalam wadah tertutup rapat, jauh dari bahan yang tidak kompatibel, sangat penting untuk meminimalkan potensi bahaya.
| Simbol bahaya | Mengiritasi |
| Deskripsi Keamanan | Menyebabkan iritasi kulit dan mata. Cukup beracun jika tertelan. Hindari menghirup. Gunakan di area yang berventilasi baik. Kenakan APD yang sesuai. |
| Nomor identifikasi PBB | Tak dapat diterapkan |
| kode HS | Tak dapat diterapkan |
| Kelas bahaya | Tak dapat diterapkan |
| Kelompok pengepakan | Tak dapat diterapkan |
| Toksisitas | Cukup beracun jika tertelan |
Metode sintesis tembaga iodida
Cuprous iodida dapat disintesis dengan metode yang berbeda. Metode umum untuk mensintesis tembaga iodida melibatkan pencampuran bubuk halus Cu dengan yodium dan memanaskan campuran dalam lingkungan yang terkendali. Ketika suhu meningkat, Cu bereaksi dengan yodium membentuk kupro iodida.
Pendekatan lain adalah dengan menambahkan tembaga oksida (CuO) atau tembaga hidroksida (Cu(OH)2) ke asam hidriodat (HI) dan memanaskan campuran. Reaksi antara asam dan senyawa tembaga menghasilkan pembentukan kupro iodida.
Cuprous iodide juga dapat diperoleh dengan mencampurkan garam Cu, seperti CuSO4 , dengan garam iodida yang larut seperti kalium iodida (KI) dalam air. Reaksi ini menyebabkan pengendapan kupro iodida.
Selain itu, reaksi perpindahan ganda antara garam Cu yang larut seperti tembaga sulfat dan garam iodida yang larut seperti natrium iodida (NaI) dalam larutan berair menghasilkan kupro iodida padat sebagai endapan. .
Metode sintesis ini menawarkan cara berbeda untuk memperoleh kupro iodida, sehingga memungkinkan penggunaannya dalam berbagai aplikasi dalam kimia dan industri.
Kegunaan tembaga iodida
Cuprous iodide menemukan aplikasi serbaguna di berbagai bidang karena sifatnya yang unik. Berikut beberapa kegunaan utamanya:
- Sintesis organik: Cuprous iodida berfungsi sebagai katalis dalam reaksi organik, mendorong berbagai reaksi penggandengan seperti reaksi Ullmann, Sonogashira, dan Glaser.
- Semikonduktor: Digunakan dalam produksi semikonduktor, terutama sebagai bahan semikonduktor tipe-P.
- Perangkat Fotovoltaik: Cuprous iodide digunakan dalam sel surya dan fotodetektor karena sifat fotokonduktivitas dan penyerapan cahayanya.
- Elektroplating: Digunakan sebagai aditif elektrolitik dalam rendaman elektroplating untuk meningkatkan deposisi tembaga.
- Pigmen: Warna kuning cerah dari cuprous iodide menjadikannya berharga sebagai pigmen dalam industri keramik dan kaca.
- Cat antifouling: Merupakan komponen penting cat antifouling untuk aplikasi kelautan.
- Reagen Kimia: Cuprous iodide digunakan di laboratorium sebagai reagen kimia untuk berbagai pengujian dan eksperimen.
- Agen kontras sinar-X: Dalam pencitraan medis, agen kontras tembaga iodida digunakan untuk pemeriksaan sinar-X.
- Pengawet kayu: Cuprous iodide melindungi kayu dari pembusukan dan serangan serangga, sehingga berguna dalam industri kayu.
- Fungisida: Bertindak sebagai fungisida yang efektif, melindungi tanaman dan tanaman dari infeksi jamur.
Banyaknya aplikasi Cuprous iodida menunjukkan pentingnya hal ini di banyak industri, mulai dari elektronik dan fotovoltaik hingga pertanian dan obat-obatan.
Pertanyaan:
Q: Bagaimana cara membuat tembaga iodida?
A: Cuprous iodide dapat disintesis dengan mereaksikan logam tembaga atau oksida tembaga dengan yodium atau dengan reaksi perpindahan ganda menggunakan tembaga sulfat dan kalium iodida.
T: Apakah tembaga iodida larut dalam air?
J: Tidak, tembaga iodida (CuI2) tidak larut dalam air.
Q: Apa persamaan molekul reaksi tembaga II nitrat dan kalium iodida?
A: Persamaan molekulnya adalah Cu(NO3)2 + 2KI → CuI2 + 2KNO3.
T: Apa rumus kupro iodida?
A: Rumus kupro iodida adalah CuI2.
T: Apakah tembaga(II) iodida tidak larut?
A: Ya, tembaga(II) iodida (CuI2) tidak larut dalam air.
T: Apakah aman untuk mencampurkan tembaga sulfat dan kalium iodida?
J: Pencampuran CaSO4 dan kalium iodida dapat menghasilkan tembaga iodida, namun kehati-hatian harus dilakukan karena reaktivitas bahan kimia yang terlibat.
Q: Apa nama senyawa yang mempunyai rumus CUI2?
A: Senyawa dengan rumus CUI2 adalah kupro (II) iodida.
T: Apakah CUI2 merupakan endapan?
J: Ya, CUI2 dapat membentuk endapan pada beberapa reaksi karena kelarutannya yang rendah dalam air.
T: Apakah CUI2 larut dalam air?
A: Tidak, CUI2 tidak larut dalam air.
T: Apakah CUI2 dapat larut?
J: Tidak, CUI2 tidak larut dalam sebagian besar pelarut umum.
T: Apa yang membuat CUI2 sulit diterapkan?
J: Rendahnya kelarutan CUI2 disebabkan oleh ikatan ionik yang kuat antara tembaga dan yodium, sehingga menyebabkan terbatasnya disosiasi dalam air.
