Tembaga(I) oksida adalah bubuk berwarna merah atau coklat dengan rumus kimia Cu2O. Ini digunakan sebagai pigmen, katalis dan sel surya karena sifat semikonduktornya.
| Nama IUPAC | Tembaga(I) oksida |
| Formula molekul | Cu2O |
| nomor CAS | 1317-39-1 |
| Sinonim | Tembaga oksida, Cuprite, Tembaga oksida, Delafossite, Tembaga monoksida, Tembaga suboksida |
| Di ChI | InChI=1S/2Cu.O |
massa molar Cu2O
Massa molar Cu2O adalah 143,09 g/mol. Nilai ini dihitung dengan menjumlahkan berat atom dua atom tembaga (63,55 g/mol x 2) dan satu atom oksigen (15,99 g/mol). Massa molar adalah sifat penting suatu senyawa kimia yang membantu menentukan jumlah zat yang ada dalam sampel tertentu. Ini juga digunakan dalam perhitungan stoikiometri untuk menentukan jumlah reaktan yang dibutuhkan untuk suatu reaksi kimia.
Titik didih Cu2O
Cu2O tidak memiliki titik didih karena terurai sebelum mencapai titik didihnya. Ketika dipanaskan, ia terurai menjadi logam tembaga dan gas oksigen. Suhu penguraian Cu2O sekitar 900°C. Oleh karena itu, Cu2O terutama digunakan sebagai bahan padat, seperti pigmen atau semikonduktor.
Titik lebur Cu2O
Titik leleh Cu2O adalah 1232°C. Nilai ini lebih tinggi dibandingkan kebanyakan logam dan oksida logam. Cu2O memiliki titik leleh yang tinggi karena ikatan ionik yang kuat antara atom tembaga dan oksigen. Titik leleh yang tinggi membuat Cu2O berguna dalam aplikasi suhu tinggi, seperti glasir keramik dan bahan tahan api.
Kepadatan Cu2O g/ml
Massa jenis Cu2O adalah 6,01 g/cm³. Nilai ini lebih tinggi dibandingkan densitas logam tembaga (8,96 g/cm³) karena adanya atom oksigen. Kepadatan Cu2O yang tinggi membuatnya berguna dalam berbagai aplikasi, seperti dalam pembuatan konduktor listrik dan semikonduktor.
Berat molekul Cu2O
Berat molekul Cu2O adalah 143,09 g/mol. Nilai ini dihitung dengan menjumlahkan berat atom dua atom tembaga dan satu atom oksigen. Berat molekul Cu2O merupakan parameter penting untuk menentukan sifat fisik dan kimia suatu senyawa. Ini juga digunakan dalam perhitungan stoikiometri untuk menentukan jumlah reaktan yang dibutuhkan untuk suatu reaksi kimia.
struktur Cu2O
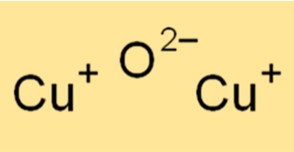
Cu2O memiliki struktur kristal kubik. Struktur kristal Cu2O mirip dengan garam batu (NaCl). Kisi kristal Cu2O tersusun dari atom tembaga yang terkoordinasi dengan atom oksigen dengan perbandingan 1:1. Struktur kristal Cu2O menjadikannya bahan yang berguna dalam berbagai aplikasi, seperti pembuatan semikonduktor dan katalis.
Rumus Tembaga(I) Oksida
Rumus kimia tembaga(I) oksida adalah Cu2O. Rumusnya menyatakan bahwa tembaga(I) oksida terdiri dari dua atom tembaga dan satu atom oksigen. Rumus tembaga(I) oksida digunakan untuk menentukan stoikiometri reaksi kimia yang melibatkan tembaga(I) oksida. Ini juga digunakan untuk menghitung massa molar dan berat molekul suatu senyawa. Rumus kimia tembaga(I) oksida penting dalam menentukan sifat fisik dan kimianya, seperti warna, titik leleh, dan kepadatannya.
| Penampilan | Bubuk merah atau coklat |
| Berat jenis | 6,01 gram/cm³ |
| Warna | Merah atau coklat |
| Bau | Tidak berbau |
| Masa molar | 143,09 g/mol |
| Kepadatan | 6,01 gram/cm³ |
| Titik fusi | 1232°C |
| Titik didih | Rusak sebelum direbus |
| Titik kilat | Tak dapat diterapkan |
| Kelarutan dalam air | Tidak larut |
| Kelarutan | Larut dalam asam pekat dan amonium hidroksida |
| Tekanan uap | Tak dapat diterapkan |
| Kepadatan uap | Tak dapat diterapkan |
| PKa | Tak dapat diterapkan |
| PH | 8.0 – 9.0 (suspensi 10% dalam air) |
Keamanan dan Bahaya Tembaga(I) Oksida
Cu2O relatif aman untuk ditangani, namun harus ditangani dengan hati-hati karena potensi bahayanya. Ini mengiritasi mata, kulit dan sistem pernafasan. Kontak langsung dengan bubuk Cu2O dapat menyebabkan iritasi kulit, sedangkan menghirup bubuk Cu2O dapat menyebabkan iritasi saluran pernafasan. Ini juga merupakan padatan yang mudah terbakar dan dapat terbakar jika terkena panas atau nyala api. Cu2O dapat bereaksi hebat dengan zat tertentu, seperti asam dan halogen, serta melepaskan gas beracun. Tindakan pencegahan yang memadai harus dilakukan saat menangani Cu2O, seperti mengenakan pakaian pelindung dan menghindari kontak dengan bahan yang tidak kompatibel.
| Simbol bahaya | Xn: Berbahaya |
| Deskripsi Keamanan | S22: Jangan menghirup debu. S36/37/39: Kenakan pakaian pelindung, sarung tangan, dan pelindung mata/wajah yang sesuai. S46: Jika tertelan, segera dapatkan bantuan medis dan tunjukkan wadah atau label ini. |
| Sebuah pengidentifikasi | UN3077 |
| kode HS | 28255000 |
| Kelas bahaya | 9 – Berbagai bahan berbahaya |
| Kelompok pengepakan | AKU AKU AKU |
| Toksisitas | Toksisitasnya rendah, namun dapat menyebabkan iritasi pada mata, kulit, dan sistem pernapasan jika bersentuhan langsung atau terhirup. |
Metode sintesis tembaga(I) oksida
Ada berbagai metode untuk mensintesis tembaga(I) oksida (Cu2O), termasuk oksidasi termal, pengendapan, deposisi elektrokimia, dan reduksi kimia.
Oksidasi termal melibatkan pemanasan logam tembaga hingga suhu tinggi dengan adanya oksigen atau udara untuk membentuk Cu2O. Prosesnya dapat dilakukan di dalam oven atau dengan oksidasi api.
Pengendapan melibatkan reaksi garam tembaga dengan larutan basa, seperti natrium hidroksida, untuk membentuk endapan Cu2O. Endapannya dapat disaring, dicuci dan dikeringkan untuk memperoleh bubuk Cu2O.
Deposisi elektrokimia melibatkan elektrolisis larutan garam tembaga menggunakan elektroda inert untuk mengendapkan Cu2O pada permukaan elektroda.
Reduksi kimia melibatkan reduksi ion tembaga menggunakan zat pereduksi, seperti natrium borohidrida atau hidrazin, dengan adanya zat penstabil, seperti polivinilpirolidon.
Metode lain melibatkan dekomposisi termal tembaga format dengan adanya zat pereduksi, seperti urea, untuk membentuk Cu2O.
Setiap metode sintesis mempunyai kelebihan dan kekurangan dalam hal rendemen, kemurnian dan skalabilitas. Penting untuk hati-hati memilih metode yang tepat berdasarkan tujuan penggunaan dan sifat Cu2O yang diinginkan.
Kegunaan Tembaga(I) Oksida
Tembaga(I) oksida memiliki beragam aplikasi karena sifat uniknya, termasuk perilaku semikonduktor, aktivitas katalitik, dan sifat antibakteri. Beberapa kegunaan umum Cu2O meliputi:
- Elektronik: Digunakan sebagai bahan semikonduktor tipe P pada perangkat elektronik seperti sel surya, fotodetektor, dan transistor efek medan.
- Katalis: Digunakan sebagai katalis dalam berbagai reaksi kimia, seperti oksidasi karbon monoksida dan reduksi nitrogen oksida.
- Pigmen: Digunakan sebagai pigmen merah pada keramik, gelas dan enamel.
- Fungisida: Digunakan sebagai fungisida untuk mengendalikan penyakit tanaman seperti hawar, penyakit bulai dan karat.
- Agen Antifouling: Digunakan sebagai agen antifouling pada cat laut untuk mencegah pertumbuhan organisme laut di kapal dan bangunan lepas pantai.
- Agen antibakteri: Memiliki sifat antibakteri. Digunakan dalam aplikasi medis seperti dressing dan pelapis antibakteri.
- Aditif: Digunakan sebagai bahan tambahan pada pakan ternak untuk mencegah kekurangan tembaga pada ternak.
Keberagaman aplikasi Cu2O menunjukkan potensinya sebagai material berharga di berbagai industri.
Pertanyaan:
T: Apakah tembaga(I) oksida berbahaya saat kering?
J: Cu2O tidak dianggap berbahaya jika kering, namun dapat menyebabkan iritasi pernapasan jika dihirup dalam bentuk bubuk.
T: Apakah tembaga(I) oksida merupakan senyawa alami?
A: Ya, Cu2O merupakan senyawa alami yang terdapat pada mineral tertentu, seperti cuprite dan tenorit.
T: Apa yang melarutkan tembaga(I) oksida?
A: Cu2O tidak larut dalam air dan sebagian besar pelarut organik. Ia dapat dilarutkan dalam asam kuat, seperti asam klorida, dan dalam larutan amonia atau kalium sianida.
T: Apa metode kimia untuk membuat lapisan tembaga(I) oksida pada logam tembaga?
J: Metode kimia untuk membuat lapisan Cu2O pada logam tembaga melibatkan perendaman tembaga dalam larutan tembaga sulfat dan natrium klorida, kemudian memanaskan tembaga di udara untuk mengoksidasi permukaannya.
T: Bagaimana tembaga dapat diekstraksi dari tembaga(I) oksida?
J: Tembaga dapat diekstraksi dari Cu2O dengan memanaskan senyawa dengan karbon atau zat pereduksi lain untuk mereduksi Cu2O menjadi logam tembaga.
Q: Berapa mol tembaga yang dibutuhkan untuk membuat 1 mol Cu2O?
A: Dibutuhkan 2 mol tembaga untuk membuat 1 mol Cu2O.
T: Apa itu Cu2O?
A: Cu2O adalah rumus kimia untuk tembaga(I) oksida, bubuk berwarna merah atau merah kecoklatan yang merupakan oksida tembaga.
T: Apa yang terjadi jika tembaga(I) oksida terdapat pada permukaan tembaga?
J: Ketika tembaga(I) oksida terdapat pada permukaan tembaga, ia dapat bertindak sebagai lapisan pelindung terhadap oksidasi dan korosi lebih lanjut pada logam tembaga.
