Tembaga hidroksida (Cu(OH)2) adalah padatan biru yang terbentuk dari reaksi garam tembaga dengan ion hidroksida. Ini digunakan sebagai fungisida dan dalam berbagai proses kimia.
| Nama IUPAC | Tembaga(II) hidroksida |
| Formula molekul | Cu(OH)2 |
| nomor CAS | 20427-59-2 |
| Sinonim | Tembaga hidroksida; Tembaga dihidroksida; CuOH2 |
| Di ChI | InChI=1S/Cu.2H2O/jam;2*1H2/q+2;;/p-2 |
Sifat tembaga hidroksida
Rumus Tembaga Hidroksida
Rumus kimia kupri hidroksida adalah Cu(OH)2. Ini mewakili kombinasi ion tembaga (Cu2+) dan dua ion OH- yang disatukan oleh ikatan ionik. Senyawa padat berwarna biru ini umum digunakan di berbagai industri karena sifatnya yang unik.
Massa Molar Tembaga Hidroksida
Massa molar kupri hidroksida (Cu(OH)2) dapat dihitung dengan menjumlahkan massa atom unsur-unsur penyusunnya. Tembaga (Cu) memiliki massa atom sekitar 63,55 g/mol dan setiap ion OH- memiliki massa atom gabungan sekitar 17,01 g/mol. Oleh karena itu, massa molar kupri hidroksida kira-kira 97,55 g/mol.
Titik didih tembaga hidroksida
Tembaga hidroksida tidak memiliki titik didih yang jelas karena ia terurai sebelum mencapai titik didihnya. Ketika dipanaskan, ia mengalami reaksi dekomposisi termal dengan pembentukan oksida tembaga dan uap air.
Titik lebur tembaga hidroksida
Tembaga hidroksida memiliki titik leleh sekitar 200°C (392°F). Pada suhu ini, zat padat mengalami transisi fasa dan berubah menjadi wujud cair.
Massa jenis tembaga hidroksida g/mL
Kepadatan tembaga hidroksida kira-kira 3,36 g/mL. Nilai ini mewakili massa satu mililiter kupri hidroksida, yang menunjukkan kekompakan dan konsentrasinya.
Berat Molekul Tembaga Hidroksida
Berat molekul kupri hidroksida kira-kira 97,55 g/mol. Ini dihitung dengan menambahkan berat atom semua atom yang ada dalam molekul tembaga hidroksida.
Struktur tembaga hidroksida
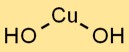
Cupric hidroksida mempunyai struktur kristal, dengan ion Cu2+ dikelilingi oleh ion OH- dalam susunan trigonal planar. Susunan kisi kristal ini berkontribusi terhadap stabilitas dan sifat khasnya.
Kelarutan tembaga hidroksida
Cupric hidroksida memiliki kelarutan terbatas dalam air. Ia membentuk suspensi yang sukar larut dalam air, artinya hanya sedikit senyawa yang larut dalam pelarut. Kelarutan dapat dipengaruhi oleh faktor-faktor seperti suhu dan pH.
| Penampilan | Biru Padat |
| Berat jenis | ~3,36 gram/mL |
| Warna | Biru |
| Bau | Tidak berbau |
| Masa molar | ~97,55 g/mol |
| Kepadatan | ~3,36 gram/mL |
| Titik fusi | ~200°C (392°F) |
| Titik didih | Terurai |
| Titik kilat | T/A |
| Kelarutan dalam air | Sulit larut |
| Kelarutan | Terbatas, bervariasi menurut suhu dan tingkat pH |
| Tekanan uap | T/A |
| Kepadatan uap | T/A |
| pKa | T/A |
| pH | Alkali (dasar) |
Keamanan dan Bahaya Tembaga Hidroksida
Tembaga hidroksida menimbulkan pertimbangan keamanan dan bahaya tertentu. Umumnya dianggap memiliki toksisitas rendah, namun dapat menyebabkan iritasi pada kulit, mata, dan saluran pernapasan jika bersentuhan atau terhirup. Tindakan perlindungan yang memadai, seperti memakai sarung tangan dan kacamata pengaman, harus dilakukan saat menangani senyawa ini. Jika terjadi konsumsi atau paparan yang tidak disengaja, perhatian medis segera diperlukan. Selain itu, tembaga hidroksida harus disimpan di tempat yang aman dan berventilasi baik, jauh dari zat yang tidak kompatibel. Prosedur pembuangan yang benar harus diikuti untuk menghindari kontaminasi terhadap lingkungan. Mengikuti tindakan pencegahan keselamatan sangat penting untuk meminimalkan potensi risiko yang terkait dengan tembaga hidroksida.
| Simbol bahaya | Tidak ada |
| Deskripsi Keamanan | Toksisitas rendah; Mengiritasi |
| Nomor identifikasi PBB | Tak dapat diterapkan |
| kode HS | 2825.90.5000 |
| Kelas bahaya | Tidak tergolong berbahaya |
| Kelompok pengepakan | Tidak diklasifikasikan |
| Toksisitas | Lemah |
Metode sintesis tembaga hidroksida
Ada beberapa metode aktif untuk mensintesis kupri hidroksida.
Pendekatan umum melibatkan reaksi garam Cu, seperti CuSO4 , dengan basa kuat seperti natrium hidroksida (NaOH) atau kalium hidroksida (KOH) . Selama proses ini, ion hidroksida (OH-) dari basa menggantikan ion sulfat (SO4^2-) dalam CuSO4 , membentuk kupri hidroksida (Cu(OH)2) sebagai endapan biru.
Metode lain melibatkan reaksi garam tembaga(II) dengan amonia (NH3). Dengan menambahkan amonia ke dalam larutan Cu(II), kupri hidroksida mengendap karena kombinasi ion Cu2+ dengan ion hidroksida amonia.
Elektrolisis memungkinkan sintesis kupri hidroksida dengan merendam elektroda Cu dalam larutan elektrolit dan menerapkan arus listrik searah. Reduksi air di katoda menghasilkan ion hidroksida, yang mengarah pada pembentukan kupri hidroksida.
Metode sintesis aktif ini menyediakan cara yang terkontrol dan efisien dalam memproduksi kupri hidroksida untuk berbagai aplikasi industri dan penelitian.
Kegunaan tembaga hidroksida
Tembaga hidroksida banyak digunakan di berbagai industri karena sifatnya yang unik dan serbaguna. Beberapa kegunaan penting meliputi:
- Fungisida: Petani banyak menggunakannya sebagai fungisida pelindung untuk mengendalikan penyakit jamur pada tanaman seperti buah-buahan, sayuran dan tanaman hias.
- Zat Antara Kimia: Ini berfungsi sebagai zat antara kimia yang berharga dalam sintesis berbagai senyawa tembaga, seperti oksida tembaga dan garam tembaga.
- Pengawet kayu: Mengolah kayu dan memberikan perlindungan terhadap serangga pemakan kayu dan jamur penyebab pembusukan, sehingga memperpanjang umur struktur kayu.
- Agen antibakteri: Dalam beberapa formulasi, ia bertindak sebagai agen antibakteri, dapat diterapkan dalam lingkungan medis dan perawatan kesehatan.
- Pengolahan Perairan: Membantu mengelola alga dan gulma air di kolam, danau, dan badan air lainnya, menjaga keseimbangan ekologi.
- Industri keramik dan kaca: Produsen menggunakannya sebagai pewarna untuk memberikan warna biru dan hijau cerah pada produk keramik dan kaca.
- Kembang api: Berkontribusi pada pewarnaan kembang api dan suar, berperan dalam aplikasi kembang api.
- Pembuatan baterai: Ia digunakan dalam produksi baterai sebagai bahan elektroda, memfasilitasi penyimpanan energi.
- Cat dan Pelapis: Beberapa formulasi cat menggabungkannya untuk memberikan sifat pelindung dan antimikroba.
Keragaman aplikasi menyoroti pentingnya tembaga hidroksida di berbagai industri, menjadikannya senyawa berharga untuk berbagai kegunaan praktis.
Pertanyaan:
T: Apakah tembaga hidroksida larut?
A: Cupric hydroxide memiliki kelarutan yang terbatas dalam air, membentuk suspensi yang sukar larut.
Q: Berapa mol dalam 68 gram tembaga(II) hidroksida Cu(OH)2?
A: Terdapat sekitar 0,697 mol Cu(OH)2 dalam 68 gram.
T: Apakah tembaga II hidroksida larut dalam air?
A: Cupric II hidroksida memiliki kelarutan terbatas dalam air.
T: Apakah natrium hidroksida dan tembaga sulfat merupakan reaksi kimia?
A: Ya, reaksi antara NaOH dan CuSO4 menghasilkan pembentukan kupri hidroksida dan natrium sulfat.
T: Apakah tembaga(II) hidroksida dapat larut?
A: Tembaga(II) hidroksida memiliki kelarutan yang terbatas dalam air.
T: Apa warna tembaga hidroksida?
A: Cupric hidroksida berwarna biru.
T: Apakah tembaga hidroksida bersifat basa?
A: Tembaga hidroksida merupakan basa tetapi tidak diklasifikasikan sebagai alkali.
T: Apakah tembaga hidroksida merupakan basa kuat?
A: Tembaga hidroksida tidak dianggap sebagai basa kuat.
Q: Apakah Cu(OH)2 larut dalam air?
A: Cu(OH)2 memiliki kelarutan yang terbatas dalam air.
Q: Berapa mol dalam 68 gram tembaga(II) hidroksida Cu(OH)2?
A: Terdapat sekitar 0,697 mol Cu(OH)2 dalam 68 gram.
Q: Berapa mol dalam 34 gram Cu(OH)2?
A: Terdapat sekitar 0,3485 mol Cu(OH)2 dalam 34 gram.
Q: Apakah padatan Cu(OH)2 terbentuk ketika 0,075 g KOH dilarutkan dalam 1,0 L Cu(NO3)2 pada 1,0 × 10^−3 M?
A: Ya, padatan Cu(OH)2 terbentuk sebagai endapan akibat reaksi antara KOH dan Cu(NO3)2.
