Tembaga bromida (CuBr2) adalah senyawa yang terbuat dari tembaga dan bromin. Ia menunjukkan warna biru-hijau, sering digunakan dalam sintesis organik dan sebagai katalis asam Lewis.
| Nama IUPAC | Tembaga(II) bromida |
| Formula molekul | CuBr2 |
| nomor CAS | 7789-45-9 |
| Sinonim | Cupric bromida, tembaga dibromida |
| Di ChI | InChI=1S/Br2.Cu |
Sifat tembaga bromida
Rumus Tembaga Bromida
Rumus kupri bromida adalah CuBr2. Ini mewakili senyawa yang terbentuk dari satu atom tembaga dan dua atom brom. Kombinasi ini menghasilkan zat kristal berwarna biru kehijauan, yang biasa digunakan dalam berbagai reaksi kimia.
Massa Molar Tembaga Bromida
Massa molar kupri bromida kira-kira 223,36 gram per mol. Nilai ini diperoleh dengan menjumlahkan massa atom satu atom tembaga (Cu) dan dua atom brom (Br) yang ada dalam rumus CuBr2.
Titik didih tembaga bromida
Cupric bromide memiliki titik didih sekitar 1.294 derajat Celsius (sekitar 2.361 derajat Fahrenheit). Suhu ini menunjukkan titik di mana suatu zat berubah dari cair menjadi gas pada tekanan atmosfer standar.
Titik lebur tembaga bromida
Titik leleh kupri bromida adalah sekitar 498 derajat Celsius (sekitar 928 derajat Fahrenheit). Suhu ini mewakili titik di mana zat padat berubah menjadi cair ketika dipanaskan.
Massa jenis tembaga bromida g/mL
Kepadatan kupri bromida kira-kira 4,71 gram per mililiter (g/mL) pada suhu kamar standar dan tekanan atmosfer. Nilai ini menunjukkan jumlah massa yang ada per satuan volume suatu zat.
Berat Molekul Tembaga Bromida
Cupric bromida memiliki berat molekul sekitar 223,36 gram per mol. Nilai ini sangat penting untuk berbagai perhitungan kimia dan berfungsi sebagai acuan jumlah zat yang ada dalam sampel tertentu.
Struktur tembaga bromida
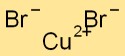
Cupric bromide memiliki struktur kisi kristal dimana atom tembaga dikelilingi oleh atom brom dan sebaliknya. Susunan ini membentuk pola yang stabil dan teratur, sehingga berkontribusi terhadap sifat fisik senyawa.
Kelarutan tembaga bromida
Cupric bromide memiliki kelarutan terbatas dalam air. Ini lebih larut dalam pelarut organik. Kelarutan tergantung pada faktor-faktor seperti suhu dan sifat pelarut yang digunakan. Memahami kelarutannya sangat penting untuk berbagai aplikasi dalam kimia dan industri.
| Penampilan | Kristal biru-hijau |
| Berat jenis | Tidak tersedia |
| Warna | Biru hijau |
| Bau | Tidak berbau |
| Masa molar | 223,36 g/mol |
| Kepadatan | 4,71 gram/ml |
| Titik fusi | 498°C (928°F) |
| Titik didih | 1294°C (2361°F) |
| Titik kilat | Tak dapat diterapkan |
| Kelarutan dalam air | Kelarutan terbatas |
| Kelarutan | Larut dalam pelarut organik seperti etanol, eter dan benzena |
| Tekanan uap | Tidak tersedia |
| Kepadatan uap | Tidak tersedia |
| pKa | Tidak tersedia |
| pH | Tidak tersedia |
Keamanan dan bahaya tembaga bromida
Cupric bromide menimbulkan pertimbangan keamanan dan bahaya tertentu. Penting untuk menangani senyawa ini dengan hati-hati karena potensi toksisitas dan sifat iritasinya. Kontak langsung dengan kulit atau mata dapat menyebabkan iritasi dan ketidaknyamanan. Menghirup debu atau asapnya dapat mengiritasi saluran pernafasan. Oleh karena itu, peralatan pelindung diri yang sesuai, seperti sarung tangan dan kacamata, harus dipakai saat bekerja dengan cupric bromide. Selain itu, harus disimpan jauh dari bahan yang tidak kompatibel untuk menghindari kemungkinan reaksi. Jika tertelan atau terpapar secara tidak sengaja, segera dapatkan bantuan medis. Kepatuhan terhadap tindakan pencegahan keselamatan sangat penting untuk memastikan penanganan dan penggunaan tembaga bromida yang aman.
| Simbol bahaya | Iritasi, Korosif |
| Deskripsi Keamanan | Tangani dengan deposit. Hindari kontak langsung dengan kulit dan mata. Gunakan peralatan pelindung yang sesuai. |
| Nomor identifikasi PBB | Tidak tersedia |
| kode HS | Tidak tersedia |
| Kelas bahaya | Mengiritasi |
| Kelompok pengepakan | Tidak tersedia |
| Toksisitas | Dapat menyebabkan iritasi kulit dan mata. Menghirup debu atau asap dapat mengiritasi saluran pernafasan. |
Metode sintesis tembaga bromida
Ada beberapa metode untuk mensintesis kupri bromida (CuBr2). Pendekatan umum melibatkan kombinasi langsung logam tembaga atau oksida tembaga dengan asam hidrobromat . Dalam metode ini, kita menambahkan tembaga ke dalam asam, dan asam tersebut mengalami reaksi kimia, menghasilkan pembentukan kupri bromida dan pelepasan gas hidrogen.
Cara lainnya adalah reaksi antara tembaga karbonat atau tembaga hidroksida dengan asam hidrobromat. Karbonat atau hidroksida bereaksi dengan asam menghasilkan kupri bromida, air dan karbon dioksida.
Selain itu, untuk mensintesis kupri bromida, reaksi perpindahan ganda dapat digunakan. Metode ini melibatkan reaksi antara garam tembaga yang larut, seperti tembaga sulfat, dan garam bromida yang larut, seperti natrium bromida. Reaksi tersebut mengarah pada pembentukan kupri bromida dan garam larut dari logam atau metaloid lain yang ada dalam reaksi.
Selain itu, untuk mensintesis kupri bromida, kita dapat menggunakan metode elektrokimia. Metode ini melibatkan penggunaan sel elektrokimia dengan elektroda tembaga dan sumber ion bromida. Ketika kita menerapkan arus, kupri bromida terbentuk pada satu elektroda, sementara gas brom dilepaskan pada elektroda lainnya.
Pilihan metode sintesis bergantung pada faktor-faktor seperti ketersediaan reagen, kemurnian yang diinginkan, dan luasnya reaksi. Penanganan yang tepat dan tindakan pencegahan keselamatan harus diperhatikan selama semua prosedur sintetis.
Kegunaan tembaga bromida
Tembaga bromida (CuBr2) dapat digunakan secara serbaguna di berbagai industri karena sifatnya yang unik. Berikut beberapa kegunaannya yang penting:
- Sintesis organik : Cupric bromide berfungsi sebagai katalis dalam banyak reaksi organik, seperti kopling Ullmann dan reaksi Wurtz-Fittig, memungkinkan pembentukan ikatan karbon-karbon dan karbon-heteroatom.
- Fotografi : Digunakan dalam proses fotografi untuk menyadarkan emulsi dan meningkatkan sensitivitas film dan pelat, sehingga memfasilitasi pengambilan gambar berkualitas tinggi.
- Pelapisan listrik : Tembaga bromida digunakan dalam proses pelapisan listrik untuk menyimpan lapisan tembaga pada permukaan, memberikan ketahanan terhadap korosi dan penyelesaian dekoratif.
- Industri semikonduktor : Di sektor elektronik, digunakan dalam sintesis nanokristal berdasarkan kupri bromida, yang memiliki aplikasi dalam optoelektronik dan fotonik.
- Pewarna Api : Tembaga bromida digunakan dalam kembang api dan kembang api untuk menghasilkan warna api hijau, menambah daya tarik visual pada tampilan.
- Pengobatan : Meskipun terbatas, obat ini telah dieksplorasi untuk aplikasi terapeutik potensial karena sifat antibakterinya.
- Teknologi Laser : Laser tembaga bromida digunakan dalam penelitian ilmiah, studi fluoresensi yang diinduksi laser, dan untuk menghasilkan pulsa laser berenergi tinggi.
- Analisis kimia : Digunakan dalam kimia analitik untuk analisis kualitatif dan kuantitatif.
- Reaksi brominasi : Cupric bromide bertindak sebagai agen brominasi, memfasilitasi penambahan brom ke senyawa organik.
- Litografi : Dalam proses litografi, senyawa tembaga bromida telah diselidiki untuk digunakan dalam teknik mikro dan fabrikasi nano.
Berbagai penerapan kupri bromida menunjukkan pentingnya dalam berbagai bidang, menjadikannya senyawa berharga dalam upaya industri dan ilmiah.
Pertanyaan:
Q: Berapa massa molar tembaga(II) bromida?
A: Massa molar kupri(II) bromida kira-kira 223,36 g/mol.
T: Apa rumus tembaga(II) bromida?
A: Rumus kupri(II) bromida adalah CuBr2.
T: Apakah tembaga(II) bromida larut dalam air?
A: Cupric(II) bromida memiliki kelarutan yang terbatas dalam air.
T: Untuk apa tembaga(II) bromida digunakan?
A: Tembaga(II) bromida digunakan sebagai katalis dalam sintesis organik, fotografi, pelapisan listrik, dan industri semikonduktor.
T: Apakah seng dan tembaga bromida merupakan pengganti satu kali saja?
J: Ya, seng dan tembaga(II) bromida mengalami reaksi penggantian tunggal, menghasilkan seng bromida dan logam Cu.
Q: Apakah reaksi terjadi ketika larutan barium asetat dan tembaga(II) bromida digabungkan?
J: Ya, terjadi reaksi yang menghasilkan pembentukan barium bromida dan tembaga(II) asetat.
T: Ion apa, jika ada, yang terbentuk ketika tembaga(II) bromida ditambahkan ke air?
A: Ketika kupri(II) bromida ditambahkan ke dalam air, ia terdisosiasi menjadi ion Cu^2+ dan ion bromida (Br^-).
Q: Apakah CuBr2 membentuk ikatan ionik?
J: Ya, CuBr2 membentuk ikatan ionik antara ion tembaga dan brom.
Q: Apakah CuBr2 membentuk ikatan kovalen?
A: Tidak, CuBr2 tidak membentuk ikatan kovalen.
Q: Apakah CuBr2 larut dalam air?
A: CuBr2 memiliki kelarutan yang terbatas dalam air.
T: Apa itu CuBr2?
A: CuBr2 adalah rumus kimia untuk kupri(II) bromida, senyawa kristal biru-hijau.
Q: Apakah CuBr2 larut atau tidak larut?
A: CuBr2 sulit larut dalam air.
Q: Berapa persentase massa tembaga dalam CuBr2?
A: Persentase massa tembaga dalam CuBr2 kira-kira 47,5%.
