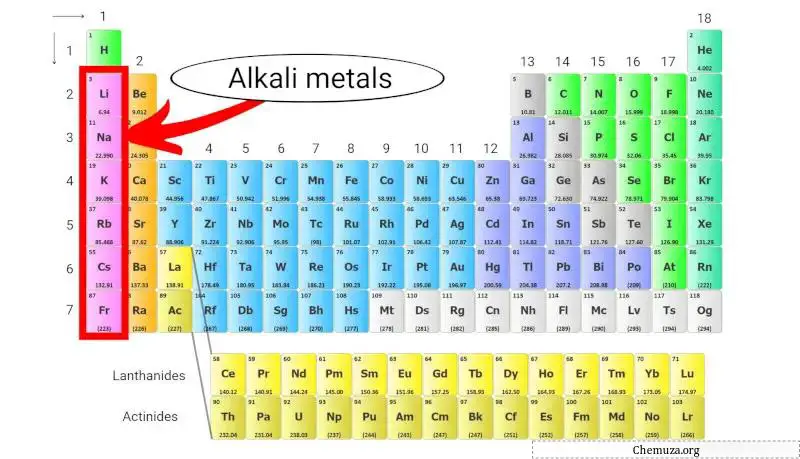
Logam alkali adalah sekelompok unsur kimia yang terletak di kolom pertama tabel periodik . Kelompok ini mencakup litium , natrium , kalium , rubidium , cesium, dan fransium .
Logam alkali bersifat lunak dan memiliki titik leleh dan titik didih yang rendah. Mereka umumnya digunakan dalam baterai, paduan dan berbagai reaksi kimia.
Mari kita telusuri lebih jauh tentang logam alkali pada tabel periodik.
Apa itu logam alkali?

Logam alkali adalah sekelompok unsur kimia dalam tabel periodik yang termasuk dalam golongan 1 .
Unsur-unsur ini dikenal karena kelembutannya, titik lelehnya yang rendah, reaktivitasnya yang tinggi, dan kemampuannya membentuk larutan basa ketika bereaksi dengan air.
Beberapa sifat utama logam alkali meliputi:
- Mereka memiliki keelektronegatifan dan energi ionisasi yang rendah, artinya mereka cenderung mudah kehilangan elektron dan membentuk kation.
- Titik leleh dan titik didihnya rendah, sehingga relatif lunak dan mudah meleleh.
- Mereka memiliki reaktivitas tinggi dengan air dan oksigen, membuatnya reaktif di udara dan air.
- Mereka adalah konduktor panas dan listrik yang baik.
Mengapa logam alkali disebut demikian?

Logam alkali disebut demikian karena mampu membentuk larutan basa kuat ketika bereaksi dengan air. [1]
Ketika logam-logam ini bersentuhan dengan air, mereka melepaskan gas hidrogen dan membentuk ion hidroksida, yang memberikan larutan pH basa .
Penjelasan:
Reaktivitas logam alkali dengan air disebabkan oleh energi ionisasinya yang rendah [2] , artinya logam alkali mudah kehilangan elektron dan membentuk ion positif (kation).
Ketika mereka bersentuhan dengan air, mereka mengalami reaksi kimia di mana mereka kehilangan elektron dan bereaksi dengan molekul air membentuk ion hidroksida dan gas hidrogen.
Reaksi ini melepaskan banyak panas, yang dapat menyebabkan gas hidrogen menyala dan meledak.
Urutan reaktivitas logam alkali
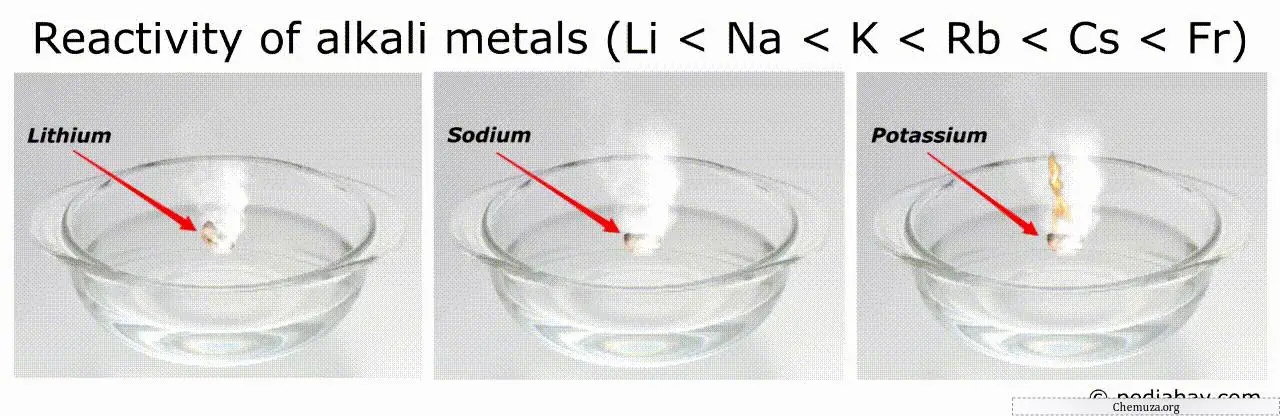
Kecenderungan umum dalam urutan reaktivitas logam alkali adalah meningkat seiring dengan penurunan golongan dari litium (Li) ke fransium (Fr).
Ini berarti fransium adalah logam alkali yang paling reaktif, sedangkan litium adalah yang paling tidak reaktif.
Alasan kecenderungan ini adalah semakin ke bawah golongan suatu unsur, jari-jari atom suatu unsur bertambah, sedangkan energi ionisasinya berkurang.
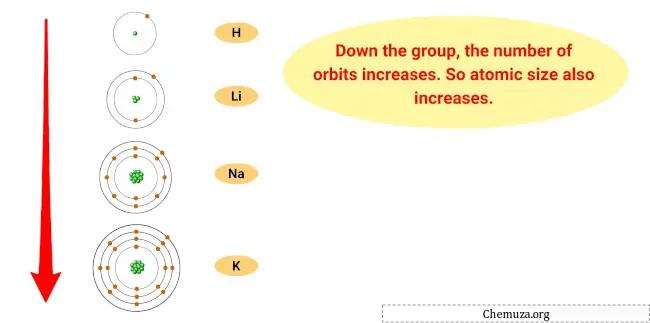
Artinya, elektron terluar atom berada lebih jauh dari inti dan tidak terikat erat, sehingga memudahkan unsur kehilangan elektron tersebut dan menjadi kation.
Fransium, yang merupakan kelompok terbesar dan paling tidak berkerabat dekat, oleh karena itu merupakan kelompok yang paling reaktif.
Urutan reaktivitas ini mempunyai implikasi penting terhadap sifat dan perilaku logam alkali.
Misalnya, logam yang paling reaktif (seperti fransium dan cesium) dapat terbakar secara spontan di udara atau air, sehingga sangat berbahaya untuk ditangani.[3]
Sebaliknya, logam yang kurang reaktif (seperti litium) lebih stabil dan dapat digunakan dalam aplikasi yang memerlukan logam lebih stabil.
Daftar logam alkali dan konfigurasi elektroniknya
Logam alkali dan konfigurasi elektroniknya ditunjukkan di bawah ini.
| Elemen | Konfigurasi elektronik |
| Litium (Li) | [Itu] 2s 1 |
| Natrium (Na) | [Lakukan] 3s 1 |
| Kalium (K) | [Ar] 4s 1 |
| Rubidium (Rb) | [Kr] 5s 1 |
| sesium (Cs) | [Xe] 6s 1 |
| Fransium (Fr) | [Rn] 7 detik 1 |
Tren periodik pada logam alkali
Tren periodik logam alkali disebutkan di bawah ini:
- Tren Valensi: Valensi logam alkali selalu +1, artinya cenderung kehilangan elektron untuk membentuk kation yang stabil. Oleh karena itu, tidak ada perubahan dalam valensi logam alkali seiring dengan bertambahnya golongan ke bawah. Mereka semua memiliki valensi yang sama (yaitu 1).
- Tren ukuran atom: Ukuran atom logam alkali meningkat seiring dengan bertambahnya golongan, yang berarti atom menjadi lebih besar. Hal ini karena seiring bertambahnya tingkat energi, ukuran awan elektron bertambah.
- Tren Karakter Logam: Karakter logam logam alkali meningkat seiring dengan bertambahnya golongan. Hal ini karena logam menjadi lebih elektropositif dan lebih mampu menyumbangkan elektron untuk membentuk ikatan logam.
- Tren Keelektronegatifan: Keelektronegatifan logam alkali menurun seiring dengan bertambahnya golongan. Hal ini karena atom menjadi lebih besar dan elektron terluar semakin jauh dari inti, sehingga daya tariknya berkurang.
- Tren Afinitas Elektron: Afinitas elektron logam alkali menurun seiring dengan penurunan golongan. Memang benar, di bagian bawah golongan, ukuran atom bertambah, yang menurunkan kecenderungan atom untuk menerima elektron. (Baca lebih lanjut tentang tren afinitas elektron di sini, untuk pemahaman lebih detail).
- Tren Energi Ionisasi: Energi ionisasi logam alkali menurun seiring dengan bertambahnya golongan. Artinya, lebih mudah melepaskan elektron dari kulit terluar atom, karena jarak elektron dari inti atom dan ikatannya kurang erat.
Ringkasan
Logam alkali adalah sekelompok unsur kimia yang dikenal karena kelembutannya, titik leleh rendah, reaktivitas tinggi, dan kemampuan membentuk larutan basa ketika bereaksi dengan air.
Urutan reaktivitas logam alkali meningkat seiring dengan penurunan golongan dari litium ke fransium karena peningkatan jari-jari atom dan penurunan energi ionisasi.
Tren periodik pada logam alkali mencakup peningkatan ukuran atom dan karakter logam seiring dengan penurunan golongan, serta penurunan keelektronegatifan, afinitas elektron, dan energi ionisasi.
Valensi logam alkali selalu +1 dan konfigurasi elektroniknya mengikuti model [gas mulia] ns 1 .
